Чтобы поделиться, нажимайте
Представляем вашему вниманию Реальный вариант ЕГЭ по химии 2021, который был предложен учащимся из Центральных регионов 31.05.2021 года.
Скачать Реальный вариант ЕГЭ по химии 2021. Центр в формате pdf
Ответы вы найдёте в конце страницы
Подготовил репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Часть 1
Ответом к заданиям 1–26 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) Cr 2) Si 3) Sc 4) O 5) N
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
- Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число неспаренных электронов.
Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три p-элемента. Расположите выбранные элементы в порядке увеличения валентности в их летучих водородных соединениях.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разницу между высшей и низшей возможными степенями окисления.
Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два вещества немолекулярного строения, в которых присутствует ковалентная полярная химическая связь.
1) хлорид аммония
2) пероксид натрия
3) сероводород
4) оксид кремния (IV)
5) бромид лития
Запишите номера выбранных ответов.
- Установите соответствие между классом/группой и формулой вещества, которое принадлежит к этому (этой) классу/группе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| КЛАСС/ГРУППА | ФОРМУЛА ВЕЩЕСТВА |
| А) кислоты | 1) Cr(OH)2 |
| Б) основания | 2) H2Cr2O7 |
| В) основные соли | 3) Cr2(SO4)3 |
| 4) (CuOH)2CO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с которыми реагирует оксид фосфора (III).
1) HCl
2) SiO2
3) O2
4) NaOH
5) CO2
Запишите номера выбранных ответов.
- Даны две пробирки с раствором гидроксида лития. В одну из них добавили нерастворимое в воде вещество Х. В результате чего вещество полностью растворилось. Во вторую пробирку добавили раствор вещества Y. В этой пробирке произошла реакция, которая описывается следующим сокращённым ионным уравнением
NH4+ + OH— = NH3 + H2O.
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) оксид цинка
2) нитрат аммония
3) оксид магния
4) карбонат кальция
5) гидрофосфат аммония
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) SrO | 1) CuSO4, O2, SO2 |
| Б) Si | 2) Cu, Ba(OH)2, MgCO3 |
| В) Ca(HCO3)2 | 3) H3PO4, HBr, Ca(OH)2 |
| Г) HNO3 | 4) O2, Mg, NaOH |
| 5) CO2, ZnO, H3PO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al2(SO4) и K2SO3 (p-p) | 1) K2CrO4, Na2CrO4 и H2O |
| Б) K2Cr2O7 и NaOH | 2) K2Cr2O7, K2SO4 и H2O |
| В) Al2(SO4)3 (изб.) и KOH | 3) Al(OH)3 и K2SO4 |
| Г) Al2(SO4)3 и KOH (изб.) | 4) Na2Cr2O7 и KOH |
| 5) Al(OH)3, K2SO4 и SO2 | |
| 6) K[Al(OH)4] и K2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) H2O
2) NaCl
3) NaOH (изб.)
4) Cu(OH)2
5) NH3∙H2O (изб.)
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) пропилацетат | 1) спирты |
| Б) глицерин | 2) соли |
| В) формиат калия | 3) сложные эфиры |
| 4) простые эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, молекулы которых содержат гидроксильные группы.
1) фруктоза
2) этилацетат
3) ацетон
4) толуол
5) этиленгликоль
Запишите номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с которыми реагирует и дивинил, и толуол.
1) метан
2) бромоводород
3) перманганат калия
4) бром
5) вода
Запишите номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с которыми реагирует и фенол и формальдегид.
1) Ag2O (NH3 p-p)
2) H2
3) KMnO4
4) Cu
5) FeCl3
Запишите номера выбранных веществ.
- Из предложенного перечня суждений выберите два, которые верно описывают белки.
1) в составе имеют пептидные связи
2) при кислотном гидролизе образуют аминокислоты
3) при взаимодействии с концентрированной азотной кислотой при нагревании дают фиолетовое окрашивание
4) образуются при гидролизе жиров
5) находятся в газообразном агрегатном состоянии при н.у.
Запишите номера выбранных веществ.
- Установите соответствие между схемой реакции и углеродсодержащим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| А) CH3-CH(Br)-CH3 + Na → | 1) этаналь |
| Б) CH2=CH2 + KMnO4 (H2O) → |
2) пропанол-2 |
| В) CH≡CH + H2O (Hg2+) → | 3) пропанон |
| Г) CH≡C-CH3 + H2O (Hg2+) → | 4) этиленгликоль |
| 5) 2,3-диметилбутан | |
| 6) н-гексан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой реакции и углеродсодержащим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| 1) бензол | |
| 2) фенол | |
| 3) бензойная кислота | |
| 4) углекислый газ | |
| 5) муравьиная кислота | |
| 6) диметиловый эфир |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) этаналь
2) этилен
3) этанол
4) этин
5) бромэтен
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие спиртового раствора этилата натрия с водой.
1) гидролиза
2) присоединения
3) отщепления
4) гидратации
5) гомогенная
Запишите номера выбранных ответов.
- Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость реакции:
Fe (тв) + 2H+ (р-р) = Fe2+ (р-р) + H2 (г).
1) использование порошка железа вместо гранул железа
2) повышение давления
3) разбавление раствора кислоты
4) увеличение концентрации кислоты в растворе
5) повышение температуры
Запишите номера выбранных ответов.
- Установите соответствие между схемой реакции и свойством азота, которое этот элемент проявляет в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО АЗОТА |
| А) Cu + NO2 → N2 + CuO | 1) не проявляет окислительно-восстановительных свойств |
| Б) NH4Cl + FeO → FeCl2 + NH3 + H2O | 2) является и окислителем и восстановителем |
| В) NO2 + O2 + H2O → HNO3 | 3) является окислителем |
| 4) является восстановителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| 1) KCl | 1) металл и кислород |
| 2) Cu(NO3)2 | 2) водород и галоген |
| 3) K2S | 3) металл и галоген |
| 4) NaClO4 | 4) водород и кислород |
| 5) металл и азот | |
| 6) водород и сера |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) нитрат бария | 1) гидролизуется по аниону |
| Б) ацетат железа (II) | 2) гидролизуется по катиону |
| В) хлорид аммония | 3) гидролизу не подвергается |
| Г) гидрокарбонат натрия | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между способом воздействия на равновесную систему
Pb2+ (p-p) + 2I— (p-p) ⇄ PbI2 (тв) + Q,
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление твердого нитрата свинца | 1) смещается в сторону прямой реакции |
| Б) понижение температуры | 2) смещается в сторону обратной реакции |
| В) повышение давления | 3) практически не смещается |
| Г) добавление твёрдого иодида лития |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАГЕНТ |
| А) этилбензол и бензол | 1) KMnO4 (H+) |
| Б) бромэтан и циклогексен | 2) ZnO |
| В) бутаналь и бутановая кислота | 3) Na |
| Г) фенол и этанол | 4) KOH |
| 5) FeCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой и названием полимера: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
- Вычислите массу 12 %-го раствора нитрата натрия, который нужно добавить к 20 г 6%-го раствора нитрата натрия, чтобы получить 10 %-й раствор соли. (Запишите число с точностью до целых.)
- Какой объём газа выделится при разложении 110 л метана на простые вещества (объёмы газов измерены при одинаковых условиях). (Запишите число с точностью до целых.)
- При окислении 2,3 г этанола оксидом меди (II) образуется ацетальдегид. Найти массу альдегида. (Запишите число с точностью до десятых.)
Не забудьте перенести все ответы в бланк ответов №1 в соответствии с инструкцией по выполнению работы.
Проверьте, чтобы каждый ответ был записан в строке с номером соответствующего задания.
Часть 2
Для записи ответов на задания 30–35 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (30, 31 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
нитрат алюминия, бром, нитрат бария, оксид серы (IV), гидроксид хрома (III), гидрокарбонат калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием раствора двух кислот. В ответ запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите вещества, реакция ионного обмена между которыми протекает с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионные уравнения только одной из возможных реакций.
- Сульфид натрия прореагировал с нитритом натрия в присутствии серной кислоты. Образовавшийся при этом газ собрали в колбу и наблюдали, как при стоянии на воздухе газ в колбе постепенно окрасился в бурый цвет. Полученный бурый газ смешали с кислородом и пропустили через воду, при этом образовалась кислота. В полученный концентрированный раствор кислоты внесли сульфид меди (I), при этом наблюдали его полное растворение и выделение бурого газа. Напишите уравнения четырёх описанных реакций.
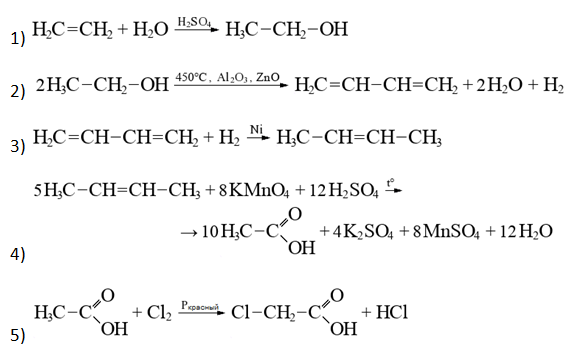
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
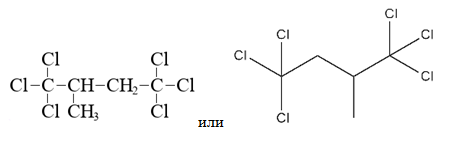
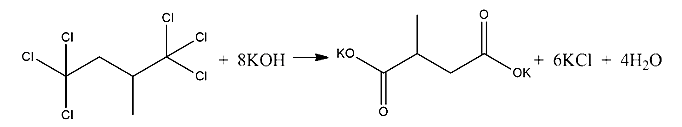
- Смесь гидроксида и хлорида бария растворили в воде. Раствор разлили на три колбы. В первую колбу, масса раствора в которой равна 520 г, добавили избыток серной кислоты, при этом выпало 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20% раствора соляной кислоты, при этом массовая доля кислоты уменьшилась в 2 раза. Найдите массовые доли веществ в третьей колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- 35. При сгорании органического вещества А массой 6,975 г получили 5,5 г углекислого газа и 3,36 л (н.у.) хлороводорода. При гидролизе вещества А в присутствии гидроксида калия образуется органическая соль Б, не содержащая атомов хлора. Молекула вещества А содерж,ит третичный атом углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза вещества А в присутствии гидроксида калия. (используйте структурные формулы органических веществ).
Реальный вариант ЕГЭ по химии 2021. Центр
Ответы:
Первая часть:
- 24
- 452
- 25
- 14
- 213
- 34
- 12
- 5432
- 5136
- 53
- 312
- 15
- 34
- 23
- 12
- 5413
- 4362
- 23
- 15
- 1345
- 314
- 2164
- 3421
- 1131
- 1115
- 431
- 40
- 220
- 2,2
Вторая часть:
- Br2 + SO2 + 2H2O = 2HBr + H2SO4
S+4 – 2e = S+6 1
Br20 + 2e = 2Br-1 1
Сера в степени окисления +4 (или SO2) является восстановителем.
Бром в степени окисления 0 (или Br2) является окислителем.
- Al(NO3)3 + 3KHCO3 = Al(OH)3↓ + 3CO2↑ + 3KNO3
Al3+ + 3NO3— + 3K+ + 3HCO3— = Al(OH)3 + 3CO2 + 3K+ + 3NO3—
Al3+ + 3HCO3— = Al(OH)3 + 3CO2
- 1) Na2S + 8NaNO2 + 4H2SO4 = 8NO + 5Na2SO4 +4H2O
или 2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O
2) 2NO + O2 = 2NO2
3) 4NO2 + O2 + 2H2O = 4HNO3
4) Cu2S + 12HNO3 → CuSO4 + Cu(NO3)2 + 6H2O + 10NO2
- W(BaCl2) = 20%, W(Ba(OH)2) = 6,6%
Решение: смотри видео
- 1) n (CO2) = m (CO2) / M (CO2) = 5,5 г / 44 г/моль = 0,125 моль
n (C) = n (CO2) = 0,125 моль.
n (HCl) = V (HCl) / Vm = 3,36 л / 22,4 л/моль = 0,15 моль, тогда:
n (H) = n (HCl) = 0,15 моль
n (Cl) = n (HCl) = 0,15 моль.
m (C) = n (C) ∙ M (C) = 0,125 моль ∙ 12 г/моль = 1,5 г
m (Н) = n (Н) ∙ M (Н) = 0,15 моль ∙ 1 г/моль = 0,15 г
m (Cl) = n (Cl) ∙ M (Cl) = 0,15 моль ∙ 35,5 г/моль = 5,325 г
m (O) = m (в-ва) – m (C) – m (H) – m (Cl) = 6,975 г – 1,5 г – 0,15 г – 5,325 г = 0, следовательно кислорода нет в составе вещества А.
Представим формулу вещества А в виде CxHyClz, тогда
x : y : z = 0,125 : 0,15 : 0,15 = 1 : 1,2 : 1,2 = 5 : 6 : 6
Таким образом, молекулярная формула вещества А – C5H6Cl6.
2) При этом нам известно, что при гидролизе вещества А образуется соль Б, не содержащая атомов хлора, значит в структуре вещества А атомы хлора находятся в концевых положениях (в противном случае при гидролизе атомы хлора бы не взаимодействовали с водой). Другими словами, надо было подумать, в каком случае галогеналканы переходят в карбоновые кислоты или соли этих карбоновых кислот — когда у одного атома углерода сразу три атома хлора, тогда атомы хлора замепщаются на гидроксильные группы, но у одного атома углерода не может быть две и более гидроксильных шрупп, поэтому происходит трансформация в карбоксильную группу, которая затем также реагирует со щёлочью и даёт соль. Дополнительно известно, что в молекуле органического соединения А имеется третичный атом (значит от него отходит по отдельности 3 атома углерода). Отсюда строим структурную формулу вещества А:
3)
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Реальный вариант ЕГЭ по химии 2021. Сибирь
- Реальный вариант ЕГЭ по химии 2021. Урал
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Просмотреть все тесты по органической химии
- Просмотреть все тесты по неорганической химии
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
- 31.05.2021
Сборник реальных заданий с основной волны ЕГЭ 2021 по химии.
Страница будет обновляться. СОХРАНИТЕ В ЗАКЛАДКИ!
- Реальные задания ЕГЭ 2021 по всем предметам
Задания с Дальнего востока и Сибири
Комментарий с Дальнего востока
- 1- 10 задания легкие
- В 3 задание ЭО — где элементы, могут принимать одинаковую степень окисления
- В 20 задании был один ответ, выберите реакции, на которые влияет изменение концентрации кислоты. В 2 реакциях кислота была в продуках реакции, в других двух кислоты не было
- Задание 26. мономер полимер, диэтиловый эфир, глюкоза/фруктоза вроде
- Задачи 27-28 легкие
- В 30 задании должно по условии образоваться простое вещество
- 31 задание. Условие: протекает с образованием белого осадка, бромоводородная кислота, графит, нитрат серебра, KHSO4, ацетат бария, KMnO4
- Задание 34. Электролиз, что на аноде и катоде
Задание 33
В 33 странная цепочка попалась: 1,3-дибромпропан — циклопропан — (t, hcl) — X1- пропен — пропандиол — (2Hbr) — X2
31 задание
Протекает с образованием белого осадка, бромоводородная кислота, графит, нитрат серебра, KHSO4, ацетат бария, KMnO4
Задание 32
Сначала был совместный гидролиз из-за того что карбонат алюминия образовался, потом гидроксид алюминия прореагировал с щёлочью, и дальше комплекс реагировал с SO2 , и в итоге там Al(OH)3 в конце просто разложение)
35 задание
Соль дикарбоновой кислоты, нужно было написать реакцию ее сплавления с щёлочью
Новый реальный открытый вариант ЕГЭ 2021 по химии 11 класс от сайта ФИПИ (fipi) задания, ответы (решения) и разбор варианта. Контрольные измерительные материалы единого государственного экзамена 2021 года для подготовки.
Открытый вариант ЕГЭ 2021 по химии 11 класс ФИПИ: скачать вариант
Экзаменационная работа состоит из двух частей, включающих в себя 35 заданий. Часть 1 содержит 29 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом. На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
Решать открытый вариант ЕГЭ 2021 по химии 11 класс онлайн ФИПИ:
Сложные задания и ответы с открытого варианта ЕГЭ 2021:
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. 1) S 2) V 3) Mg 4) Al 5) H Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1)Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите номера выбранных элементов.
Ответ: 35
2)Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите номера выбранных элементов в нужной последовательности.
Ответ: 341
3)Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления. Запишите номера выбранных элементов.
Ответ: 35
4)Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку и содержат ковалентные неполярные связи. 1) оксид меди(II) 2) оксид углерода(II) 3) пропан 4) белый фосфор 5) гидроксид натрия
Ответ: 34
6)Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует графит. 1) соляная кислота 2) серная кислота (конц.) 3) сульфат магния 4) водород 5) гидроксид калия (р-р)
Ответ: 24
7)В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. 1) сульфат алюминия 2) нитрат магния 3) фтороводородная кислота 4) силикат калия 5) гидроксид цинка
Ответ: 21
10)Задана схема превращений веществ: 2 KI Na Br X Y ⎯⎯⎯→ ⎯⎯⎯→ Определите, какие из указанных веществ являются веществами X и Y. 1) HI 2) KIO3 3) NaBr 4) NaI 5) I2 Запишите в таблицу номера выбранных веществ под соответствующими буквами
Ответ: 54
12)Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров. 1) 1,1-дибромэтен 2) бутен-1 3) 2,3-дибромпропен 4) 1,2-дибромэтен 5) бутен-2 Запишите номера выбранных ответов.
Ответ: 45
13)Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с избытком раствора брома образуется вещество состава C4H8Br2. 1) 2-метилбутен-1 2) метилпропен 3) бутадиен-1,3 4) бутин-1 5) метилциклопропан
Ответ: 25
14)Из предложенного перечня выберите два вещества, которые могут взаимодействовать с водородом. 1) этанол 2) этиленгликоль 3) формальдегид 4) глицерин 5) фенол
Ответ: 35
15)Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота. 1) соляная кислота 2) метан 3) гидроксид натрия 4) бензол 5) медь
Ответ: 13
19)Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации. 1) серная кислота 2) оксид серы(VI) 3) сероводород 4) сульфат магния 5) сульфат аммония
Ответ: 13
20)Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления. 1) оксид магния 2) оксид серы(IV) 3) медь 4) сероводород 5) фосфин
Ответ: 245
27)Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
Ответ: 136,7
28)Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции NH4NO2(кр.) = N2(г) + 2H2O(г) + 316 кДж. (Запишите число с точностью до десятых.)
Ответ: 252,8
29)Вычислите объём (в литрах при н.у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
Ответ: 16,8
32)Серу растворили в концентрированной азотной кислоте при нагревании. Выделившийся при этом бурый газ пропустили над нагретым порошком меди. Полученное твёрдое вещество растворили в соляной кислоте. Затем к образовавшемуся раствору добавили иодоводородную кислоту, при этом наблюдали образование осадка и изменение цвета раствора. Напишите уравнения четырёх описанных реакций.
Ответ: 1. S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 2. 2NO2 + 4Cu = 4CuO + N2 3. CuO + 2HCl = CuCl2 + H2O 4. 2CuCl2 + 4НI = 2CuI + I2 + 4НCl
34)Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
35)При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода. Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2 -гибридизации, а в молекуле вещества А — в sp3 -гибридизации. На основании данных условия задачи: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Видео разбор открытого варианта ЕГЭ 2021 по химии ФИПИ:
Другие тренировочные варианты ЕГЭ 2021 по химии 11 класс:
Тренировочные варианты ЕГЭ по химии 11 класс задания с ответами
14.04.2021 варианты ХИ2010501-ХИ2010504 ответы и задания по химии 11 класс ЕГЭ 2021
ПОДЕЛИТЬСЯ МАТЕРИАЛОМ
Пробные и тренировочные варианты по химии в формате ЕГЭ 2021 из различных источников.
→ открытый вариант ЕГЭ по химии 2021 ФИПИ
Тренировочные варианты ЕГЭ 2021 по химии
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 (ЕГЭ 100БАЛЛОВ) | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| Вариант 6 | скачать |
| variant 7 | скачать |
| variant 8 | скачать |
| variant 9 | скачать |
| variant 10 | скачать |
| variant 11 | скачать |
| variant 12 | скачать |
| variant 13 | скачать |
| variant 14 | скачать |
| variant 15 | скачать |
| variant 16 | скачать |
| vk.com/chem4you | |
| Вариант 1 | ответы |
| Вариант 2 | ответы |
| Вариант 3 | ответы |
| Вариант 4 | ответы |
| Вариант 5 | ответы |
| Вариант 6 | ответы |
| Вариант 7 | ответы |
| Вариант 8 | ответы |
| Сергей Широкопояс (есть ссылка на ответы) | |
| Вариант 15 | скачать |
| Вариант 16 | скачать |
| Вариант 17 | скачать |
| Вариант 18 | скачать |
| Вариант 19 | скачать |
| Вариант 20 | скачать |
| Вариант 21 | скачать |
| Вариант 22 | скачать |
| Реальные задания ЕГЭ 2020 по химии | скачать |
→ Сборники тренировочных вариантов ЕГЭ по химии, одобренные ФИПИ.
В сборнике представлены:
• 30 типовых экзаменационных вариантов, составленных в соответствии с проектом демоверсии КИМ ЕГЭ по химии 2021 года;
• инструкция по выполнению экзаменационной работы;
• ответы ко всем заданиям;
• критерии оценивания.
Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
Учителя могут использовать типовые экзаменационные варианты для организации контроля результатов освоения школьниками образовательных программ среднего общего образования и интенсивной подготовки обучающихся к ЕГЭ.
Смотрите также:
Разбор задания 7 ЕГЭ по химии
Тренировочные задания ОГЭ по химии
Решение задач повышенной трудности задача 34 в КИМах ЕГЭ по химии
Тест по теме «Соли» Химия 10 (11) класс
Как решать задание 25 в ЕГЭ-2021 по химии
1) S 2) V 3) Mg 4) Al 5) H
1. Определите элементы, у атомов которых в основном состоянии все валентные электроны находятся только на s-подуровнях. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из числа указанных в ряду элементов выберите два элемента, которые имеют одинаковую разность между значениями их высшей и низшей степеней окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку и содержат ковалентные неполярные связи.
1) оксид меди(II)
2) оксид углерода(II)
3) пропан
4) белый фосфор
5) гидроксид натрия
Запишите номера выбранных ответов.
5. Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) NaHSO3 | 1) пероксиды |
| Б) Na2O2 | 2) кислые соли |
| В) Na2ZnO2 | 3) средние соли |
| 4) основные оксиды |
Запишите в поле ответа выбранные цифры в нужной последовательности.
6. Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует графит.
1) соляная кислота
2) серная кислота (конц.)
3) сульфат магния
4) водород
5) гидроксид калия (р-р)
Запишите номера выбранных ответов.
7. В одну пробирку с раствором вещества X добавили избыток раствора гидроксида натрия и в результате реакции наблюдали образование осадка белого цвета. В другую пробирку с раствором вещества Y также добавили раствор гидроксида натрия. В результате реакции наблюдали сначала образование осадка белого цвета, а затем его растворение. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
1) сульфат алюминия
2) нитрат магния
3) фтороводородная кислота
4) силикат калия
5) гидроксид цинка
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
8. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) Cu | 1) H2SiO3, CrCl3, K2SO4 |
| Б) CuO | 2) H2SO4 (p-p), HNO3 (конц.), HCl (р-р) |
| В) Fe(OH)3 | 3) H2SO4 (конц.), HNO3 (p-p), O2 |
| Г) NH4Cl | 4) AgNO3, Ba(OH)2, KOH |
| 5) CH4, KMnO4, NaH |
Запишите в поле ответа выбранные цифры в нужной последовательности.
9. Установите соответствие между реагирующими веществами и продуктом(-ами), который(-е) образуется(-ются) при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) CO2 и Сa(OH)2 (изб.) | 1) FeI2 и K2SO4 |
| Б) Fe2(SO4)3 и KI (p-p) | 2) Fe(OH)3, K2SO4 и HI |
| В) CO2 (изб.) и Сa(OH)2 | 3) CaCO3 и H2O |
| Г) Ca(HCO3)2 и Сa(OH)2 | 4) CaCO3, CO2 и H2O |
| 5) Ca(HCO3)2 | |
| 6) FeI2, I2 и K2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
10. Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) HI
2) KIO3
3) NaBr
4) NaI
5) I2
Запишите в поле ответа номера выбранных веществ в нужной последовательности.
11. Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) анилин | 1) аминокислоты |
| Б) аланин | 2) кетоны |
| В) ацетон | 3) амины |
| 4) спирты |
Запишите в поле ответа выбранные цифры в нужной последовательности.
12. Из предложенного перечня выберите два вещества, которые существуют в виде цис-транс-изомеров.
1) 1,1-дибромэтен
2) бутен-1
3) 2,3-дибромпропен
4) 1,2-дибромэтен
5) бутен-2
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с избытком раствора брома образуется вещество состава C4H8Br2.
1) 2-метилбутен-1
2) метилпропен
3) бутадиен-1,3
4) бутин-1
5) метилциклопропан
Запишите в поле ответа номера выбранных веществ.
14. Из предложенного перечня выберите два вещества, которые могут взаимодействовать с водородом.
1) этанол
2) этиленгликоль
3) формальдегид
4) глицерин
5) фенол
Запишите в поле ответа номера выбранных веществ.
15. Из предложенного перечня выберите два вещества, с которыми реагирует аминоуксусная кислота.
1) соляная кислота
2) метан
3) гидроксид натрия
4) бензол
5) медь
Запишите в поле ответа номера выбранных веществ.
16. Установите соответствие между схемой реакции и органическим продуктом, который преимущественно образуется в результате этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ |
| А) CH3C≡CH + H2O (Hg2+) → | 1) пропан |
| Б) CH3CHClCH2Cl + Zn → | 2) пропанон |
| В) CH3CCl2CH3 + NaOH(водн.) → | 3) пропанол-1 |
| Г) CH3CH2CH2Cl + NaOH(водн.) → | 4) пропанол-2 |
| 5) пропен | |
| 6) пропаналь |
Запишите в поле ответа выбранные цифры в нужной последовательности.
17. Установите соответствие между веществом и продуктом реакции этого вещества с бромоводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТ РЕАКЦИИ |
| А) этиленгликоль | 1) аминоуксусная кислота |
| Б) ацетат аммония | 2) ацетон |
| В) изопропанол | 3) 2-бромпропан |
| Г) этилат натрия | 4) этанол |
| 5) 1,2-дибромэтан | |
| 6) уксусная кислота |
Запишите в поле ответа выбранные цифры в нужной последовательности.
18. Задана следующая последовательность превращений веществ:
CH4 → X → Y → C6H12
Определите, какие из указанных веществ являются веществами Х и Y.
1) бензол
2) этан
3) толуол
4) ацетилен
5) хлорметан
Запишите в поле ответа выбранные цифры в нужной последовательности.
19. Из предложенного перечня выберите все вещества, взаимодействие которых с гидроксидом натрия является реакцией нейтрализации.
1) серная кислота
2) оксид серы(VI)
3) сероводород
4) сульфат магния
5) сульфат аммония
Запишите номера выбранных ответов.
20. Из предложенного перечня выберите все вещества, на скорость взаимодействия которых с концентрированным раствором азотной кислоты при комнатной температуре оказывает влияние изменение давления.
1) оксид магния
2) оксид серы(IV)
3) медь
4) сероводород
5) фосфин
Запишите в поле ответа номера выбранных воздействий.
21. Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ |
| А) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 | 1) +4 → +5 |
| Б) 2NH3 + 3CuO = N2 + 3Cu + 3H2O | 2) –3 → 0 |
| В) 3NO2 + H2O = 2HNO3 + NO | 3) –2 → 0 |
| 4) –3 → +2 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
22. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) Ca(NO3)2 | 1) металл, водород, кислород |
| Б) Li2SO4 | 2) водород, кислород |
| В) BaCl2 | 3) металл, водород, галоген |
| Г) AgNO3 | 4) металл, галоген |
| 5) водород, галоген | |
| 6) металл, кислород |
Запишите в поле ответа выбранные цифры в нужной последовательности.
23. Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) Hg(NO3)2 | 1) кислая |
| Б) NaNO3 | 2) нейтральная |
| В) Na3PO4 | 3) щелочная |
| Г) AuCl3 |
Запишите в поле ответа выбранные цифры в нужной последовательности.
24. Установите соответствие между способом воздействия на равновесную систему
CH3CH2COOCH(CH3)2(ж) + H2O(ж) ←→ CH3CH2COOH(ж) + (CH3)2CHOH(ж) − Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры | 1) смещается в сторону прямой реакции |
| Б) добавление твёрдой щёлочи | 2) смещается в сторону обратной реакции |
| В) добавление воды | 3) практически не смещается |
| Г) понижение давления |
Запишите в поле ответа выбранные цифры в нужной последовательности.
25. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) уксусная кислота и этанол | 1) Br2 (водн.) |
| Б) бутин-1 и бутин-2 | 2) лакмус |
| В) метан и пропилен | 3) фенолфталеин |
| Г) этилен и ацетилен | 4) Ag2O (NH3 р-р) |
| 5) KCl |
Запишите в поле ответа выбранные цифры в нужной последовательности.
26. Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) анилин | 1) в качестве моторного топлива |
| Б) ацетилен | 2) газовая сварка металлов |
| В) толуол | 3) в качестве растворителя |
| 4) производство красителей и лекарств |
Запишите в поле ответа выбранные цифры в нужной последовательности.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин в бланке ответа указывать не нужно. При проведении расчётов для всех элементов, кроме хлора, используйте значения относительных атомных масс, выраженные целыми числами (Ar(Cl) = 35,5).
27. Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
28. Вычислите количество теплоты, выделяющееся при разложении 51,2 г нитрита аммония в соответствии с термохимическим уравнением реакции
NH4NO2(кр.) = N2(г) + 2H2O(г) + 316 кДж.
(Запишите число с точностью до десятых.)
29. Вычислите объём (в литрах при н.у.) ацетилена, который выделится при взаимодействии 48 г карбида кальция с избытком воды. (Выход продукта считать 100%.) (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ: уксусная кислота, сульфат лития, перманганат натрия, карбонат натрия, серная кислота, иодид магния. Допустимо использование водных растворов веществ.
30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества и солей. Запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
5MgI2 + 2NaMnO4 + 8H2SO4 = 5MgSO4 + Na2SO4 + 2MnSO4 + 5I2 + 8H2O
2I–1 − 2𝑒̅ = I2 |5
Mn+7 + 5𝑒̅ = Mn+2 |2
MgI2 (I–1) – восстановитель, NaMnO4 (Mn+7) – окислитель.
31. Из предложенного перечня выберите сильный и слабый электролиты, между которыми возможна реакция ионного обмена, протекающая с образованием газа. Запишите молекулярное, полное и сокращённое ионные уравнения только одной возможной реакции.
2CH3COOH + Na2CO3 = 2CH3COONa + CO2 + H2O
2Na+ + CO32– + 2CH3COOH = 2Na+ + 2CH3COO– + CO2 + H2O
CO32– + 2CH3COOH = 2CH3COO– + CO2 + H2O
32. Серу растворили в концентрированной азотной кислоте при нагревании. Выделившийся при этом бурый газ пропустили над нагретым порошком меди. Полученное твёрдое вещество растворили в соляной кислоте. Затем к образовавшемуся раствору добавили иодоводородную кислоту, при этом наблюдали образование осадка и изменение цвета раствора. Напишите уравнения четырёх описанных реакций.
1. S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
2. 2NO2 + 4Cu = 4CuO + N2
3. CuO + 2HCl = CuCl2 + H2O
4. 2CuCl2 + 4НI = 2CuI + I2 + 4НCl
33. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
34. Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
1. Запишем уравнения реакций:
(1) Сa(NO3)2 = Ca(NO2)2 + O2
(2) 2Ca(NO3)2 = 2CaO + 4NO2 + O2
(3) 4KOH + 4NO2 + O2 = 4KNO3 + 2H2O
2. Масса исходного гидроксида калия
m(KOH) = mр-ра · ω (KOH) = 133,6 · 0,4 = 53,44 г
3. Вычислим количества вещества газов в реакции (2)
Пусть n2(O2) = x моль, тогда n2(NO2) = 4x моль
В реакцию (3) кислород и оксид азота (IV) вступают в таком же соотношении, следовательно:
n3(O2) = x моль, тогда n3(NO2) = 4x моль
m3(O2) = 32x г, тогда m3(NO2) = 4x · 46 = 184х г
При этом в реакцию вступило:
nпрореаг.(KOH) = 4х моль
mпрореаг.(KOH) = 4х·56 = 224х г
mост.(KOH) = 53,44 — 224х г
Масса конечного раствора:
mр-ра = 133,6 + 32х + 184х = 133,6 + 216х
Получаем выражение:
ω2(KOH) = mост.(KOH) / mр-ра ·
0,2 = (53,44 – 224x) / (133,6 + 216х)
x = 0,1 моль
n2(O2) = 0,1 моль, n2(NO2) = 0,4 моль
Следовательно, в реакцию (2) вступило:
n2(Сa(NO3)2) = 0,2 моль
По условию:
V1(O2) : V2(исх. смеси газов) = n1(O2) : (n1(O2) + n2(O2) + n2(NO2)) = 1 : 2
Отсюда n1(O2) = 0,5 моль
n1(Сa(NO3)2) = 0,5 моль
nобщ.(Сa(NO3)2) = 0,5 + 0,2 = 0,7 моль
mобщ.(Сa(NO3)2) = n · M = 0,7 · 164 = 114,8 г
35. При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода. Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества А — в sp3-гибридизации. На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
1. Общая формула вещества СxHyСlzOt
n(CO2) = V : VM = 20,16 : 22,4 = 0,9 моль= n(C)
n(HCl) = V : VM = 20,16 : 22,4 = 0,9 моль= n(Cl) = n(H)
m(O) = 43,65 – 12 · 0,9 – 1 · 0,9 – 35,5 · 0,9 = 0
𝑥 ∶ 𝑦 ∶ 𝑧 = 0,9 ∶ 0,9 ∶ 0,9 = 1 ∶ 1 ∶ 1 = 6 ∶ 6 ∶ 6
Молекулярная формула С6H6Cl6
2. Структурная формула
3. Уравнение реакции
ХИМИЯ
2022—2023 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2023 года с решениями.
2021—2022 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2022 года с решениями.
2020—2021 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2021 года с решениями.
2019—2020 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2020 года с решениями.
2018—2019 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2019 года с решениями.
ЕГЭ по химии 25.03.2019. Досрочная волна. Вариант.
ЕГЭ по химии 31.05.2019. Основная волна. Вариант.
2017—2018 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2018 года с решениями.
2016—2017 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2017 года с решениями.
ЕГЭ по химии 29.03.2017. Досрочная волна. Вариант.
2015—2016 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2016 года с решениями.
2014—2015 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2015 года с решениями.
ЕГЭ по химии 05.05.2015. Досрочная волна. Вариант.
2013—2014 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2014 года с решениями.
2012—2013 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2013 года с решениями.
2011—2012 УЧЕБНЫЙ ГОД
Демонстрационная версия ЕГЭ по химии 2012 года с решениями.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Сибирь. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Урал. Вариант 5.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 1.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 2.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 3.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 4.
ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5.
Полезная информация
Смотреть все
Мы знаем в чем причина низких баллов в 2022 году.
МЫ ЗНАЕМ КАК ИСПРАВИТЬ ЭТО В 2023 ГОДУ!
Подготовка к ЕГЭ/ОГЭ от Университета «Синергия»
Информцентр образования
Собрал необходимые материалы по всем предметам и уже разделили их по блокам, вопросам, вариантам и типам заданий на экзамене. В разделах есть официальная информация к изучению — кодификатор, спецификация ФИПИ, демоверсии, КИМ (пробные варианты) и многое другое.
Теория
Для удобства информация распределена по номерам заданий демоверсий 2023 года. Материал изложен полно, но кратко. Простым языком. Есть наглядные примеры для понимания, схемы, таблицы для запоминания.
Практика
Это удобное пособие для быстрой подготовки к экзаменам: просто выбирайте задание, которое вызвало больше всего затруднений или вопросов, и тренируйтесь. В каждом листе есть список заданий, которые вы можете пройти самостоятельно, также правильные ответы с пояснениями (обоснованиями).
Ткебучава ЛуараПодготовка к ЕГЭ/ОГЭ по биологии и химии
Образование:
- Кандидат биологических наук
- Закончила МГУ имени М.В. Ломоносова
- Старший научный сотрудник кафедры общей экологии и гидробиологии МГУ Биологического факультета МГУ имени М.В. Ломоносова
Дополнительно:
Эксперт ЕГЭ по биологии
Достижения:
За 20 лет преподавания на биофаке МГУ ни одного провала — мои ученики пополнили ряды МГУ имени М.В. Ломоносова (биофак, психфак, медфак), I-II-III Медицинские институты, РУДН и даже далекий китайский Шенчжень! Использую оригинальные курсы и авторские методики преподавания: деловые игры, круглые столы, конференции для школьников и студентов, дополнительные курсы и кружки, научно-исследовательские и проектные работы.
В «Синергии» отвечает за:
- Разработку учебно-методических пособий, дидактических и наглядных материалов по химии и биологии, и их оперативной корректировке;
- Организацию проведения методических экспериментов, внедрение в учебный процесс методических достижений и новых технологий обучения.
Вопросы и ответы
Как сдать химию на 100 баллов?
С чего начать подготовку к ЕГЭ по химии с нуля?
На что стоит обратить внимание на ЕГЭ по химии?

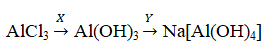 Определите, какие из указанных веществ являются веществами X и Y.
Определите, какие из указанных веществ являются веществами X и Y.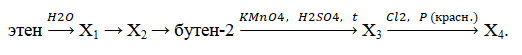 При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.