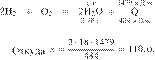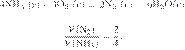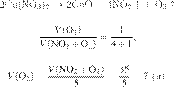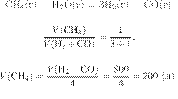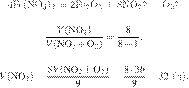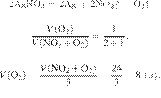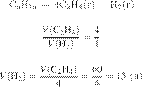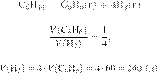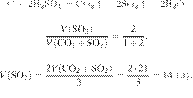Задания
Версия для печати и копирования в MS Word
Тип 27 № 9821
Дано термохимическое уравнение:
В результате реакции поглотилось 705 кДж. Вычислите массу оксида железа(III), вступившего в реакцию. Примите Ответ дайте в граммах с точностью до целых.
Спрятать решение
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 480 г.
Раздел кодификатора ФИПИ: 4.3.3 Расчеты массы вещества или объема газов
Спрятать решение
·
·
Сообщить об ошибке · Помощь
Задания
для подготовки
1.
Задание 28 № 4768
В результате
реакции, термохимическое
уравнение которой
выделилось 1479 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Ответ округлите до
целых.
Решение.
Составим пропорцию:
Ответ просят округлить до целых.
Ответ: 110 г.
2.
Задание 28 № 6258
В результате
реакции, термохимическое
уравнение которой
выделилось 171 кДж теплоты. Вычислите
массу гидроксида натрия, который был нейтрализован соляной кислотой. Ответ
укажите в граммах с точностью до целых.
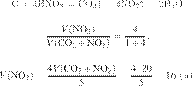
Решение.
Запишем молекулярное уравнение:
Из пропорции получаем:
Ответ: 120 г.
1/28
3.
Задание 28 № 6259
Вычислите объём
газа (н. у.), который не вступит в реакцию, если сжигать 50 л водорода в 50 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
50 л |
50 л |
0 |
|
изменение |
— 50 л |
— 25 л |
+ |
|
стало |
0 л |
25 л |
50 |
Согласно уравнению
реакции, каждые два объёма водорода реагируют с одним объёмом кислорода, и при
этом получается два объёма газообразной воды.
Тогда 50 л водорода прореагируют с
25 л кислорода, а ещё 25 л кислорода не вступят в реакцию.
Ответ просят дать с точностью до
целых.
Ответ: 25 л.
4.
Задание 28 № 6260
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
объём (н. у.) водорода, вступившего в реакцию. Ответ укажите в литрах с точностью
до десятых.
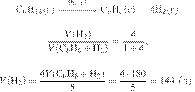
Решение.
Составим пропорцию:
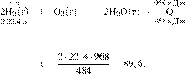
получаем:
Ответ: 89,6 л.
2/28
5.
Задание 28 № 6261
Вычислите объём
газа (н. у.), не вступит в реакцию, если сжигать 40 л угарного газа в 40 л
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
40 л |
40 л |
0 |
|
изменение |
— 40 л |
— 20 л |
+ |
|
стало |
0 |
20 л |
40 |
Согласно уравнению
реакции, каждые два объёма угарного газа реагируют с одним объёмом кислорода, и
при этом получается два объёма углекислого газа.
Тогда 40 л угарного газа
прореагируют с 20 л кислорода, а ещё 20 л кислорода не вступят в реакцию.
Ответ: 20 л.
6.
Задание 28 № 6262
В результате
реакции, термохимическое
уравнение которой
выделилось 264 кДж теплоты. Вычислите
массу образовавшейся при этом серной кислоты. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 294 г.
3/28
7.
Задание 28 № 6263
В результате
реакции, термохимическое
уравнение которой
выделилось 121 кДж теплоты. Вычислите
объём (н. у.) кислорода, который израсходован на сжигание водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Составим пропорцию:
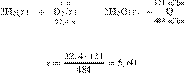
получаем:
Ответ просят дать с точностью до
десятых.
Ответ: 5,6 л.
8.
Задание 28 № 6264
Вычислите объём
азота (н. у.), который образуется при полном сгорании 20 л аммиака в избытке
кислорода. Ответ укажите в литрах с
точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные
стехиометрическим
коэффициентам в
уравнениях реакций.
Запишем
уравнение реакции и отношение
объёмов:
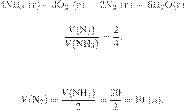
Из пропорции
имеем:
Ответ: 10 л.
4/28
9.
Задание 28 № 6265
В результате
реакции, термохимическое
уравнение которой
выделилось 28,5 кДж теплоты.
Вычислите массу азотной кислоты, которая была нейтрализована гидроксидом
калия. Ответ укажите в граммах с точностью
до десятых.
Решение.
Запишем молекулярное уравнение:
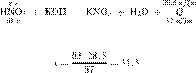
получаем:
Ответ: 31,5 г.
10.
Задание 28 № 6266
В результате
реакции, термохимическое
уравнение которой
выделилось 968 кДж теплоты. Вычислите
массу образовавшейся при этом воды. Ответ укажите в граммах с
точностью до целых.
Решение.
Составим пропорцию:
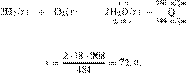
получаем:
Ответ просят дать с точностью до
целых.
Ответ: 72 г.
5/28
11.
6267
Вычислите
максимально возможный объём (н. у.) аммиака, который может быть получен исходя
из 40 л водорода и 30 л азота. Ответ укажите
в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
|
было |
30 л |
40 л |
0 |
|
изменение |
— x л |
— 3x л |
+ |
|
стало |
(30-x) л |
(40-3x) л |
2x |
Согласно уравнению
реакции, каждый объём азота реагируют с тремя объёмами водорода, и при этом
образуется два объёма аммиака. Максимально возможный объём аммиака образуется,
когда один из реагентов потратится полностью.
И максимально возможный объём
аммиака равен =
Ответ просят дать с точностью до
десятых.
Ответ: 26,7 л.
12.
Задание 28 № 6395
Вычислите объём
аммиака, который можно получить из 600 л водорода, если объемная доля выхода
аммиака равна 40 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
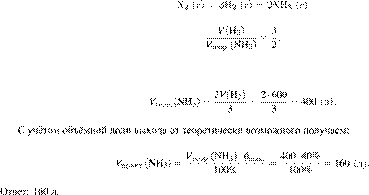
6/28
13.
6435
Вычислите объём
водорода, можно получить при разложении 250 л метана, если объемная доля выхода
водорода равна 60 %. Объемы газов измерены при одинаковых условиях. Ответ
укажите в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
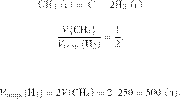
Из пропорции имеем:
С учётом объёмной доли выхода от
теоретически возможного получаем:
Ответ: 300 л.
14.
Задание 28 № 6475
Термохимическое
уравнение сгорания железа в
кислороде:
В результате
реакции выделилось 2057,5 кДж. Вычислите массу образовавшегося оксида железа(III)
Ответ дайте в граммах с точностью до целых. Решение.
Из пропорции получаем:
Ответ: 400 г.
7/28
15.
6515
Дано
термохимическое уравнение:
В реакции
поглотилось 95 кДж теплоты. Вычислите массу вступившего в реакцию углерода. Ответ
дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 10 г.
16.
Задание 28 № 6557
Вычислите объём
кислорода, который необходим для окисления 20,2 л (н. у.) водорода. Ответ
укажите в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
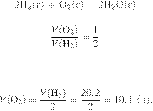
Из пропорции имеем:
Ответ: 10,1 л.
8/28
17.
6612
При полном
восстановлении 48 г оксида железа(III) избытком алюминия выделилось 256,2 кДж
теплоты. Вычислите теплоту реакции
(в кДж на моль
)
Ответ дайте с
точностью до целых (в расчётах используйте целые относительные атомные массы
элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 854 кДж.
18.
Задание 28 № 6652
При полном
восстановлении оксида свинца(II) избытком водорода образовалось 41,4 г металла
и выделилось 4,4 кДж теплоты. Вычислите теплоту
реакции
(в кДж на моль
).
Ответ дайте с точностью до целых (в
расчётах используйте целые относительные атомные массы элементов).
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 22 кДж.
9/28
19.
6692
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите массу
ацетилена, которая вступила в эту реакцию, если в результате выделилось 400 кДж?
Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 52 г.
20.
Задание 28 № 6732
Термохимическое
уравнение реакции
образования бензола из
ацетилена имеет вид:
Вычислите теплоту
(в кДж), которая выделится, если в реакцию вступит 117 г ацетилена. Ответ дайте
с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 900 кДж.
10/28
21.
6781
Вычислите объём
азота (н. у.), образуется при полном сгорании 67,2 л (н. у.) аммиака.
Ответ дайте в литрах с точностью до десятых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Из пропорции имеем:
Ответ: 33,6 л.
22.
Задание 28 № 6821
При
разложении нитрата меди(II)
образовалось 12 л оксида азота(IV).
Вычислите объём образовавшегося кислорода.
Объёмы газов измерены при одинаковых условиях. Ответ дайте в литрах с точностью
до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропрорцию:
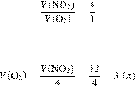
Из пропорции имеем:
Ответ: 3 л.
11/28
23.
6861
Для обжига
сульфида цинка потребовалось 240 л кислорода. Вычислите объём образовавшегося
оксида серы(IV). Объёмы газов измерены при одинаковых условиях. Ответ дайте в
литрах с точностью до целых. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции:
Составим пропорцию:
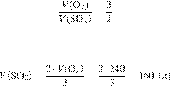
Из пропорции имеем:
Ответ: 160 л.
24.
Задание 28 № 7106
В результате реакции,
термохимическое уравнение которой
выделилось 1452 кДж теплоты.
Вычислите массу образовавшейся при этом воды (в граммах). Запишите число с
точностью до целых.
Решение.
Составим пропорцию:
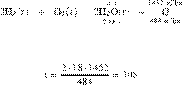
Из пропорции имеем:
Ответ: 108 г.
12/28
25.
9641
В реакцию, термохимическое уравнение
которой
вступило 88 г углекислого газа.
Вычислите количество теплоты, которое выделится при этом. Ответ дайте в кДж с
точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 204 кДж.
26.
Задание 28 № 9682
При полном
разложении нитрата меди(II) образовалась смесь газов общим объёмом 35 л. Вычислите
объём кислорода в этой смеси. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 7 л.
13/28
27.
9715
В результате
реакции выделилось 85,5 кДж теплоты. Вычислите массу оксида азота(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 45 г.
28.
Задание 28 № 9750
Вычислите объём
кислорода, который потребуется для полного окисления 500 л аммиака до оксида
азота(II) в присутствии катализатора. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 625 л.
14/28
29.
9784
Дано термохимическое уравнение:
В результате
реакции выделилось 226 кДж теплоты. Вычислите массу оксида углерода(II),
вступившего в реакцию. Ответ дайте в граммах с точностью до десятых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 22,4 г.
30.
Задание 28 № 9821
Дано термохимическое уравнение:
В результате реакции
поглотилось 705 кДж. Вычислите массу оксида железа(III), вступившего в реакцию.
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 480 г.
15/28
31.
9855
В результате реакции
выделилось 1000 кДж теплоты. Вычислите массу образовавшегося оксида меди(II).
Примите Ответ дайте в граммах с точностью до целых.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 200 г.
32.
Задание 28 № 9889
При разложении
оксида азота образовалось 25 л азота и 12,5 л кислорода. Вычислите объём
вступившего в реакцию оксида азота. Объёмы газов измерены при одинаковых
условиях. Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
По условию объём
азота в два раза больше объёма кислорода, значит, в исходном оксиде число
атомов азота в два раза больше, чем число атомов кислорода. Запишем уравнение
реакции:
Составим пропорцию:

оксида азота, получаем:
Ответ: 25 л.
16/28
33.
9923
паровой конверсии
метана образовалась смесь оксида углерода(II) и водорода общим объёмом 800 л. Вычислите
объём израсходованного метана. Объёмы газов измерены при одинаковых условиях.
Ответ дайте в литрах с точностью до целых.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 200 л.
34.
Задание 28 № 10404
Дано термохимическое уравнение:
В результате реакции выделилось 36 кДж
теплоты. Сколько граммов хлората калия разложилось?
Примите . Ответ
округлите до ближайшего целого числа. Решение.
Из пропорции получаем:
Ответ: 98.
17/28
35.
10443
В результате
реакции выделилось 19 кДж теплоты. Сколько граммов перманганата калия
разложилось? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 79 г.
36.
Задание 28 № 10674
При полном
разложении нитрата железа(II) образовались оксид железа(III) и смесь газов общим
объёмом 36 л. Чему равен объём оксида азота(IV) в этой смеси (в л)? Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 32 л.
18/28
37.
10709
полном разложении нитрата серебра
образовались серебро и смесь газов общим объёмом 24 л.
Чему равен объём кислорода в этой
смеси (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 8 л.
38.
Задание 28 № 11089
Определите объём
водорода, необходимый для полного гидрирования 50 л ацетилена. Объёмы газов
измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
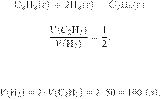
Из пропорции имеем:
Ответ: 100 л.
19/28
39.
11169
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 66 кДж теплоты. Сколько граммов гидроксида натрия вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 48 г.
40.
Задание 28 № 11234
Дано термохимическое уравнение
реакции, протекающей в водном растворе:
В результате
реакции выделилось 64 кДж теплоты. Сколько граммов азотной кислоты вступило в
реакцию? Ответ округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 72 г.
20/28
41.
11272
пиролизе (высокотемпературном разложении)
октана образовались только этилен объёмом 60 л
и водород. Чему равен объём водорода
(в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 15 л.
42.
Задание 28 № 11307
При ароматизации
гексана образовались только газообразный бензол объёмом 60 л и водород. Чему
равен объём водорода (в л)? Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 240 л.
21/28
43.
11342
Дано термохимическое уравнение:
В результате реакции поглотилось 63
кДж теплоты. Сколько граммов оксида меди(II) образовалось?
Примите Ответ округлите
до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
44.
Задание 28 № 11377
Дано термохимическое уравнение:
В результате
реакции поглотилось 35 кДж теплоты. Сколько граммов серебра образовалось? Ответ
округлите до ближайшего целого числа.
Решение.
Составим пропорцию:
Из пропорции имеем:
Ответ: 24 г.
22/28
45.
12383
растворении
углерода в концентрированной серной кислоте образовалась смесь газов общим
объёмом 21 л. Сколько литров сернистого газа содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 14.
46.
Задание 28 № 12418
При растворении
углерода в концентрированной азотной кислоте образовалась смесь газов общим
объёмом 20 л. Сколько литров оксида азота(IV) содержится в этой смеси? Ответ
приведите в виде целого числа. Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 16.
23/28
47.
12617
При сжигании
углеводорода образовалось 8 л углекислого газа и 10 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 13.
48.
Задание 28 № 12652
При сжигании
углеводорода образовалось 12 л углекислого газа и 18 л паров воды. Сколько
литров кислорода израсходовано? Ответ приведите в виде целого числа. Объёмы
газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение
реакции и используем для нахождения объёма полученные стехиометрические
коэффициенты:
Ответ: 21.
24/28
49.
12866
Термохимическое уравнение горения
алюминия имеет вид
В результате
реакции выделилось 502,5 кДж теплоты. Сколько граммов алюминия вступило в
реакцию? Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ просят округлить до десятых.
Ответ: 16,2.
50.
Задание 28 № 13034
Термохимическое уравнение горения
хрома имеет вид:
В результате
реакции выделилось 342 кДж теплоты. Сколько граммов хрома вступило в реакцию?
Ответ округлите до десятых.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 31,2.
25/28
51.
13096
Термохимическое уравнение горения
этана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 12 г этана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 570 кДж.
52.
Задание 28 № 13131
Термохимическое уравнение горения
бутана имеет следующий вид:
Сколько теплоты (в
кДж) выделится при полном сгорании 23,2 г бутана? Ответ запишите в виде целого
числа.
Решение.
Составим пропорцию:
Из пропорции получаем:
Ответ: 1060 кДж.
26/28
53.
13558
Какой объём
водорода потребуется для полного гидрирования 5,6 л пропена? Объёмы газов
измерены в одинаковых условиях. (Запишите число с точностью до десятых.)
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 5,6 л.
54.
Задание 28 № 13631
При каталитической
дегидроциклизации гексана образовалась смесь паров бензола и водорода общим
объёмом 180 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 144.
27/28
55.
13666
При каталитической
дегидроциклизации гептана образовалась смесь паров толуола и водорода общим
объёмом 260 л. Сколько литров водорода содержится в смеси? Ответ приведите в
виде целого числа. Объёмы газов измерены при одинаковых условиях.
Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 208.
56.
Задание 28 № 13705
Какой объём оксида серы(IV) выделится при
сжигании 64 л сероводорода в избытке кислорода?
Объёмы газов измерены в
одинаковых условиях. (Запишите число с точностью до целых.) Решение.
Объёмы газов,
вступающих в реакцию и образующихся в результате реакции, соотносятся как
небольшие целые числа, равные стехиометрическим коэффициентам в уравнениях
реакций.
Запишем уравнение реакции и
отношение объёмов:
Ответ: 64 л.
28/28
25. Механика, молекулярная физика (расчетная задача)

Демонстрационный вариант ЕГЭ 2019 г. – задание №25. Груз массой 1 кг, находящийся на столе, связан лёгкой нерастяжимой нитью, переброшенной через идеальный блок, с другим грузом. На первый груз действует горизонтальная постоянная сила , F равная по модулю 10 Н (см. рисунок). Второй груз движется из состояния покоя с ускорением 2 м/с2, направленным вверх. Коэффициент трения …
Читать далее
25. Алгоритмы обработки массивов

Демонстрационный вариант ЕГЭ 2018 г. – задание №25 — Дан целочисленный массив из 30 элементов. Элементы массива могут принимать целые значения от 0 до 10 000 включительно. Опишите на одном из языков программирования алгоритм, который находит количество элементов массива, больших 100 и при этом кратных 5, а затем заменяет каждый такой элемент на число, равное найденному количеству. Гарантируется, что хотя бы …
Читать далее
25. Алгоритмы обработки массивов – продолжение

Демонстрационный вариант ЕГЭ 2019 г. – задание №25 — Дан целочисленный массив из 30 элементов. Элементы массива могут принимать натуральные значения от 1 до 10 000 включительно. Опишите на одном из языков программирования алгоритм, который находит минимум среди элементов массива, не делящихся нацело на 6, а затем заменяет каждый элемент, не делящийся нацело на 6, на число, равное найденному минимуму. Гарантируется, что …
Читать далее
25. Создание программы для обработки целочисленной информаци
Создание программы для обработки целочисленной информаци
Читать далее
28. Составление плана доклада по определенной теме

Демонстрационный вариант ЕГЭ 2018 г. – задание №28. Вам поручено подготовить развёрнутый ответ по теме «Политические партии». Составьте план, в соответствии с которым Вы будете освещать эту тему. План должен содержать не менее трёх пунктов, из которых два или более детализированы в подпунктах. Досрочный вариант ЕГЭ по обществознанию 2017 г. – задание №28. Вам поручено подготовить развёрнутый ответ по теме «Типы …
Читать далее
24. Нахождение ошибок в тексте: Работа эндокринной системы

Демонстрационный вариант ЕГЭ 2017-2018-2019 г. – задание №24 Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их. Дайте правильную формулировку. Досрочный вариант ЕГЭ 2017 г. – задание №24 Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их.
Читать далее
24. Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия.

Демонстрационный вариант ЕГЭ 2017-2018-2019 г. – задание №24 Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. УРАВНЕНИЕ РЕАКЦИИ А) N2(г) + 3H2(г) -> NH3(г) Б) 2Н2(г) + О2(г) -> 2Н2О(г) В) H2(г) + Cl2(г) -> 2НCl(г) Г …
Читать далее
24. Средства связи предложений в тексте

Демонстрационный вариант ЕГЭ 2019 г. – задание №24 — Лексическое значение слова (1)Мой отец и исправник были поражены тем, что нам пришлось переночевать в доме Селивана, которого все в округе считали колдуном и разбойником и который, как мы думали, хотел нас убить и воспользоваться нашими вещами и деньгами… (2)Кстати, о деньгах. (3)При упоминании о них тётушка …
Читать далее
25. Регионы России

Демонстрационный вариант ЕГЭ 2017-2018-2019 г. – задание №25 Определите регион России по его краткому описанию. Эта область расположена в Европейской части России. Она имеет выход к Государственной границе РФ. Одна из основных отраслей промышленности – добыча железных руд и производство железорудных окатышей. Машиностроение специализируется на производстве кузнечно-прессового оборудования, электротехнических изделий, оборудования для животноводства и кормопроизводства. Электроэнергией область обеспечивает расположенная на её …
Читать далее
26. Молекулярная физика, электродинамика (расчетная задача)

Демонстрационный вариант ЕГЭ 2019 г. – задание №26. Тепловая машина с максимально возможным КПД имеет в качестве нагревателя резервуар с водой, а в качестве холодильника – сосуд со льдом при 0 оС. При совершении машиной работы 1 МДж растаяло 12,1 кг льда. Определите температуру воды в резервуаре. Ответ округлите до целых. Ответ: ___________________________ К. Демонстрационный вариант …
Читать далее
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
- Оценивание (первичные баллы) — 1
- Время на выполнение (мин) — 3-4
- Сложность — базовая
Теория по заданию 28
4.3.3. Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ
4.3.8. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного
4.3.9. Расчёты массовой доли (массы) химического соединения в смеси
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 56.5%
Ответом к заданию 28 по химии может быть целое число или конечная десятичная дробь.
Разбор сложных заданий в тг-канале
Задачи для практики
Задача 1
Рассчитайте массу серной кислоты, необходимой для полной нейтрализации 168 г гидроксида калия. (Запишите число с точностью до целых.) Ответ в (г).
Решение
Количество вещества равно отношению массы вещества к его молярной массе.
M(KOH) = 56 г/моль
n(KOH) = 168/56 = 3 моль
$2KOH + H_2SO_4 = K_2SO_4 + 2H_2O$
2 молям KOH соответствует 1 моль $H_2SO_4$, соответственно 3 молям KOH соответствует х моль $H_2SO_4$
Составим пропорцию:
2/3 = 1/x
x = 3/2 = 1.5(моль)
m = n*M
M($H_2SO_4$) = 98 г/моль
m($H_2SO_4$) = 1.5*98 = 147 (г)
Ответ: 147
Задача 2
Оксид азота(II) объёмом 80 л (н. у.) прореагировал с 30 л кислорода (н. у.). Вычислите объем не вступившего в реакцию газа. (Запишите число с точностью до целых.) Ответ в (л).
Решение
$2NO + O_2 = 2NO_2$
По коэффициентам видим, что для реакции требуется в два раза больше оксида азота(II), чем кислорода, поэтому NO вступило в реакцию 60 литров, а значит, остальные 20 не вступили в реакцию.
Ответ: 20
Задача 3
Рассчитайте массу осадка, образующегося при взаимодействии раствора, содержащего 41,6 г хлорида бария, с раствором, содержащим 20,52 г сульфата алюминия. (Запишите число с точностью до сотых.) Ответ в (г).
Решение
$Al_2(SO_4)_3 + 3BaCl_2 = 3BaSO_4↓ + 2 AlCl_3$
Найдем моли сульфата алюминия, разделив его массу на молярную массу:
$n(Al_2(SO_4)_3)$ = 20.52 / 342 = 0.06 моль
Найдем моли хлорида бария:
$n(BaCl_2) = 41,6/208 = 0,2 моль
Определяем, какое из исходных веществ было взято в недостатке (моли вещества делим на кэффициент перед ним в реакции и сравниваем): 0,06/1 < 0,2/3. Сульфат алюминия взят в недостатке. По нему и ведем расчет.
По реакции видим, что осадка в три раза больше (смотрим на коэффициенты), поэтому и моль его не 0.06, а 0.06*3 = 0.18 моль.
Найдем массу осадка, умножив его молярную массу на моль:
$m(BaSO_4)$ = 0.18 * 233 = 41.94 г.
Ответ: 41.94
Задача 4
Какой объём (н. у.) водорода можно получить при взаимодействии 0,25 моль железа с 73,5 г 40% раствора серной кислоты? Выход реакции составляет 80% (Запишите число с точностью до сотых.) Ответ в (л).
Решение
$Fe + H_2SO_4 = FeSO_4 + H_2$
Найдем моли серной кислоты: $n(H_2SO_4) = 73,5⋅0,4/98 = 0,3$ моль
Железо находится в недостатке. По нему ведем расчет.
Из уравнения видим, что моли водорода в реакции равны молям железа (коэффициенты 1 и 1), поэтому можем сразу понять, что получится 0.25 моль водорода (из данных задачи)
Найдем теоретический объем 0.25 моль $H_2$, умножив моль на молярный объем:
V($H_2^{ (теор)} $)= 0.25 * 22.4 = 5.6 л.
Найдем практический объем водорода: $V(H_2)^{практ} = 5,6⋅0,8 = 4,48$ л
Ответ: 4.48
Задача 5
При растворении в воде технического карбида кальция, содержащего 4% химически инертных примесей, выделилось 16,8 л (н. у.) газа. Вычислите массу технического карбида кальция, взятого для реакции. (Запишите число с точностью до целых.) Ответ в (г).
Решение
$CaC_2 + 2H_2O = Ca(OH)_2 + C_2H_2$
Газ в данном случае – $C_2H_2$. Найдем его количество, используя постоянную Авогадро:
n($C_2H_2$) = 16.8/22.4 = 0.75 моль
Моли карбида в реакции равны молям газа (коэффициенты 1 и 1), поэтому сразу найдем массу карбида, умножив его количество на молярную массу:
m($CaC_2$) = 64*0.75 = 48 г.
Однако исходный карбид содержал примеси (4%). Значит на чистый карбид кальция там приходится 96%.
Найдем массу исходного загрязненного образца: $m(CaC_2)_{техн.} = 48/0,96 = 50$ г.
Ответ: 50
Задача 6
Какая масса серебра выделится в результате реакции окисления 0,4 моль пропионового альдегида избытком аммиачного раствора оксида серебра, если выход реакции составляет 55,6%? (Запишите число с точностью до ЦЕЛЫХ.) Ответ в (г).
Решение
$CH_3-CH_2-CHO + 2[Ag(NH_3)_2]OH = CH_3-CH_2-COOH + 4NH_3 + H_2O + 2Ag$
$C^{+1} →^{-2e-} C^{+3} |1$
$Ag^{+1} →^{+1e-} Ag^{0} |2$
n(Ag) = $2n(CH_3-CH_2-CHO)$
n(Ag) = 2 ⋅ 0.4 = 0.8 моль
m = nM
$m(Ag)^{теор}$ = 0.8 ⋅ 108 = 86.4 г
$m(Ag)^{практ}$ = 86,4*0,556 = 48 г
Ответ: 48
Задача 7
Вычислите, какой объём газа (н. у.) выделится при растворении 19,4 г сульфида цинка в избытке разбавленной серной кислоты. (Запишите число с точностью до десятых.) Ответ в (л).
Решение
1. Уравнение реакции:
$ZnS + H_2SO_4 = ZnSO_4 + H_2S↑$
2) Находим количество вещества сульфида цинка:
M(ZnS) = 97 г/моль, n(ZnS) = 19.4 / 97 = 0.2 моль
3) По уравнению реакции:
n($H_2S$) = n(ZnS) = 0.2 моль
V($H_2S$) = 0.2 · 22.4 = 4.48 ≈ 4,5 л
Ответ: 4.5
Задача 8
Вычислите массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия. Выход реакции составляет 94,85%. Запишите число с точностью до целых. Ответ в дайте в граммах.
Решение
1. Уравнение реакции:
$C_6H_5OH + NaOH = C_6H_5ONa + H_2O$
2. Находим количество реагирующих веществ:
а) M($C_6H_5OH$) = 94 г/моль, n($C_6H_5OH$) = 9.4 / 94 = 0.1 моль
б) m$(NaOH)_{чист.}$ = 0.12 · 50 = 6 г
M(NaOH) = 40 г/моль, n(NaOH) = 6 / 40 = 0.15 моль
3. По уравнению реакции:
а) n($C_6H_5OH$) = n(NaOH), следовательно,
NaOH в избытке в количестве (0.15 – 0.1) = 0.05 моль
б) n($C_6H_5ONa$) = n($C_6H_5OH$) = 0.1 моль
M($C_6H_5ONa$) = 116 г/моль, m($C_6H_5ONa)_{теор.}$ = 0.1 · 116 = 11.6 г
m($C_6H_5ONa)_{практ.}$ = 11.6*0,9485 = 11 г
Ответ: 11
Задача 9
Сколько граммов карбоната кальция растворили в азотной кислоте, если объём выделившегося газа равен 5,6 л (н. у.)? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Формулы для расчёта:
$n = m_{в-ва} / M_{в-ва}$; $n = V_г / V_M$
1) Составляем уравнение реакции:
$CaCO_3 + 2HNO_3 = Ca(NO_3)_2 + H_2O + CO_2↑$
Устанавливаем логическую связь: найти необходимо количество вещества $CaCO_3$, расчёт — по $CO_2$:
2) Рассчитываем количество вещества углекислого газа:
$n(CO_2) = 5.6 / 22.4 = 0.25$ моль
3) Рассчитываем по уравнению реакции: поскольку моли карбоната кальция и углекислого газа соотносятся как 1 к 1, то моли $CaCO_3$ = 0.25 моль
4) Рассчитываем массу $CaCO_3$:
$M(CaCO_3)$ = 100 г/моль;
$m(CaCO_3)$ = 0.25 · 100 = 25 г
Ответ: 25
Задача 10
Рассчитайте максимальный объём (н. у.) хлороводорода, который может присоединиться к 0,25 моль ацетилена. (Запишите число с точностью до десятых, л.)
Решение
$C_2H_2 + 2HCl = H_3C-CHCl_2$
Моли ацетилена в два раза меньше моль хлороводорода (коэффициенты 1 и 2), поэтому моли хлороводорода равны:
n(HCl) = 2*0.25 = 0.5 моль
Определим объем хлороводорода:
V(HCl) = 0.5*22.4 = 11.2 л.
Ответ: 11.2
Задача 11
36 г карбида алюминия, содержащего 20 % примесей, обработали избытком воды. Какой объём газа (н. у.) выделится? (Запишите число с точностью до сотых, л.)
Решение
20% = 0.2
$m(Аl_4C_3)_{чист.}$ = 36(1 — 0.2) = 28.8г
n = m : M
n($Аl_4C_3$) = 28.8 : 144 = 0.2 моль
$Аl_4C_3 + 12H_2O = 3CH_4 + 4Al(OH)_3$
n($CH_4$) = 3n($Аl_4C_3$)
n($CH_4$) = 0.6 моль
V = nVm
V($CH_4$) = 0.6 · 22.4 = 13.44л
Ответ: 13.44
Рекомендуемые курсы подготовки
14824. При растворении карбоната кальция в избытке соляной кислоты выделилось 5,6 л (н.у.) газа. Чему равна масса карбоната кальция?

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14824.
14823. 28 г железа растворили в избытке разбавленной хлороводородной кислоты. Какой объём газа (н.у.) выделился в результате этой реакции? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14823.
14822. При взаимодействии кальция с водой образовался гидроксид кальция количеством 0,3 моль. Какой объём (н.у.) водорода при этом выделился? (Запишите число с точностью до сотых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14822.
14821. Какая масса иода выделится при взаимодействии 0,5 моль иодида калия с необходимым количеством хлора? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14821.
14820. При обжиге сульфида цинка было получено 0,5 моль оксида цинка. Какой объём (н.у.) оксида серы(IV) образовался в результате этого процесса? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14820.
14819. Какая масса осадка образуется при взаимодействии избытка раствора нитрата цинка с раствором, содержащим 11 г сульфида калия? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14819.
14818. Какая масса осадка образуется при взаимодействии избытка раствора хлорида бария с раствором, содержащим 2,84 г сульфата натрия? (Запишите число с точностью до сотых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14818.
14817. Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария с раствором, содержащим 7,84 г серной кислоты? (Запишите число с точностью до десятых.)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14817.
14816. При растворении сульфида железа(II) в избытке соляной кислоты выделилось 2,8 л (н.у.) газа. Чему равна масса сульфида железа(II)?

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14816.
14815. Масса газа, выделившегося при обработке избытком хлороводородной кислоты 3 моль сульфида натрия, равна _____ г.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 
При обращении указывайте id этого вопроса — 14815.
Для вас приятно генерировать тесты, создавайте их почаще
Пробные варианты ЕГЭ 2023 по химии с ответами для проведения тренировочных работ в 11 классе.
Все варианты в формате ЕГЭ 2023 года.
Пробные варианты ЕГЭ 2023 по химии
| Широкопояс С.И. Борисов И.С. | |
| Вариант 15 | Скачать |
| Вариант 14 | Скачать |
| Вариант 13 | Скачать |
| Вариант 12 | Скачать |
| Вариант 11 | Скачать |
| Вариант 10 | Скачать |
| Вариант 9 | Скачать |
| Вариант 8 | Скачать |
| Вариант 7 | Скачать |
| Вариант 6 | Скачать |
| vk.com/chem4you | |
| Вариант 1 | Ответы |
| Вариант 2 | Ответы |
| Вариант 3 | Ответы |
| Вариант 4 | Ответы |
| Вариант 5 | Ответы |
| Вариант 6 | Ответы |
| Вариант 7 | Ответы |
| Вариант 8 | Ответы |
| ЕГЭ 100 баллов (с решениями) | |
| Вариант 1 | скачать |
| Вариант 2 | скачать |
| Вариант 3 | скачать |
| Вариант 4 | скачать |
| Вариант 5 | скачать |
| chem.family (с ответами) | |
| Вариант 1 (легкий уровень) | скачать |
| Вариант 2 (сложный уровень) | скачать |
| Вариант 3 (сложный уровень) | скачать |
| Вариант 4 (легкий уровень) | скачать |
| Вариант 5 (легкий уровень) | скачать |
| Вариант 6 (легкий уровень) | скачать |
| Вариант 7 (легкий уровень) | скачать |
| Вариант 8 (сложный уровень) | скачать |
| Купить сборники для подготовки к ЕГЭ
→ Доронькин, Февралева: ЕГЭ 2023 Химия. 10-11 классы. Тематический тренинг. Задания базового и повышенного уровней сложности → Юрий Медведев: ЕГЭ 2023 Химия. Типовые варианты экзаменационных заданий. 14 вариантов |
Экзаменационная работа состоит из двух частей, включающих в себя 34 задания.
Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
При выполнении заданий можно пользоваться черновиком. Записи в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
При выполнении работы используйте Периодическую систему химических элементов Д.И. Менделеева, таблицу растворимости солей, кислот и оснований в воде, электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы.
Для вычислений используйте непрограммируемый калькулятор.
Смотрите также:
Открытый вариант ЕГЭ 2021 по химии
Демонстрационный вариант ЕГЭ по химии 2022
ЕГЭ по химии — типичные ошибки
Отработка задания 14 ЕГЭ по химии
Пробный вариант ЕГЭ 2021 по химии с ответами