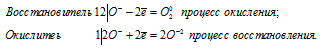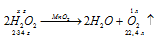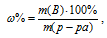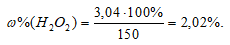Всего: 123 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
При разложении пероксида водорода выделилось 6,72 л (н. у.) кислорода.
Масса пероксида водорода, вступившего в реакцию, равна
1) 5,1 г
2) 10,2 г
3) 15,3 г
4) 20,4 г
Смесь пероксида бария (взятого в избытке) и алюминия общей массой 20,21 г подожгли. К полученному после бурной реакции твёрдому остатку добавили разбавленную серную кислоту, осадок отделили. Из оставшегося раствора при добавлении катализатора – оксида марганца (IV) выделяется 224 мл кислорода (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) кислотного оксида; В) пероксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Ответ:
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объёмом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щёлочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300 мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объём собранного газа.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Смесь оксида и пероксида бария обработали избытком серной кислоты. Осадок отфильтровали, высушили и взвесили, его масса составила 46,6 г. К полученному раствору добавили избыток раствора перманганата калия, в результате выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли веществ в исходной смеси.
Установите соответствие между формулой вещества и классом (группой) неорганических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
ФОРМУЛА НЕОРГАНИЧЕСКОГО ВЕЩЕСТВА
КЛАСС (ГРУППА) НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1) основный оксид
2) амфотерный оксид
3) кислотный оксид
4) пероксид
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите два вещества с ионной кристаллической решёткой, в которых присутствует ковалентная неполярная связь
1) пероксид натрия
2) ацетиленид натрия
3) азотная кислота
4) гидроксид кальция
5) сульфат аммония
Запишите номера выбранных веществ.
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
КЛАСС/ГРУППА
1) пероксиды
2) кислые соли
3) средние соли
4) осно́вные оксиды
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Укажите все факторы, от которых зависит скорость разложения пероксида водорода в водном растворе.
1) температура
2) объём раствора
3) давление кислорода над раствором
4) концентрация пероксида водорода
5) действие света на раствор
Запишите номера выбранных ответов в порядке возрастания.
Вычислите объём (при н. у.) кислорода, который образуется при разложении 4 моль пероксида водорода. Ответ дайте в литрах с точностью до десятых.
Источник: ЕГЭ по химии 02.04.2016. Досрочная волна
Нитрат натрия прокалили. Твердый продукт реакции нагрели с иодидом аммония, выделился газ, входящий в состав воздуха. Соль обработали раствором пероксида водорода, подкисленным серной кислотой. Образовавшееся простое вещество прореагировало при нагревании с раствором гидроксида натрия.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Пероксид водорода прореагировал с оксидом серебра (I). Выделившийся газ пропустили через нагретую трубку, наполненную сульфидом цинка. Полученный в результате этой реакции остаток прореагировал с концентрированным раствором гидроксида натрия. Полученную соль прокалили.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует натрий.
1) водород
2) сульфат калия
3) оксид алюминия
4) пероксид натрия
5) метан
Запишите номера выбранных веществ.
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: фосфат кальция, пероксид водорода, хлороводород, хлорид калия, сульфид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид бария, пероксид водорода, иодид калия, нитрат калия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: РЕШУ ЕГЭ
Источник: РЕШУ ЕГЭ
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: сероводород, пероксид водорода, гидроксид калия, оксид хрома(III), фосфат магния, сульфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Источник: ЕГЭ — 2018, основная волна. Задания 31 (С2).
Источник: ЕГЭ — 2018, основная волна. Задания 30 (С1).
Гидрокарбонат натрия смешали с раствором гидроксида натрия. К полученному раствору добавили раствор бромида хрома(III), наблюдали выпадение осадка и выделение газа. Осадок отделили и поместили в раствор, содержащий пероксид водорода и гидроксид калия, и нагрели. Полученную соль поместили в раствор серной кислоты и наблюдали изменение окраски раствора. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Нитрат калия прокалили. Твёрдый продукт реакции нагрели с иодидом аммония, при этом выделился газ, входящий в состав воздуха, а также образовалась соль. Соль обработали раствором, содержащим пероксид водорода и серную кислоту. Образовавшееся простое вещество прореагировало с раствором гидроксида натрия при нагревании. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
При взаимодействии пероксида водорода и оксида серебра выделился газ, который прореагировал с сульфидом цинка при нагревании. Образовавшееся твёрдое вещество добавили в концентрированный раствор гидроксида натрия. Полученную соль выделили и нагрели. Напишите уравнения описанных реакций.
Источник: ЕГЭ — 2018, основная волна. Задания 32 (С3).
Всего: 123 1–20 | 21–40 | 41–60 | 61–80 …
Всего: 123 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Добавить в вариант
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, хлорид хрома(III), карбонат натрия, пероксид водорода, сульфат магния, оксид меди(II). Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
1
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, хлорид хрома(III), карбонат натрия, пероксид водорода, сульфат магния, оксид меди(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа и выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОБЛАСТЬ ПРИМЕНЕНИЯ
А) получение фенола
Б) в качестве отбеливателя
В) в качестве удобрения
ВЕЩЕСТВО
1) пероксид водорода
2) нитрат калия
3) крахмал
4) кумол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2020. Основная волна. Вариант 1
Из предложенного перечня выберите два вещества, в каждом из которых присутствует как ионная, так и ковалентная неполярная химическая связь.
1) фосфат натрия
2) метилацетат
3) бензоат аммония
4) диэтиловый эфир
5) пероксид натрия
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2022. Досрочная волна
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) пропен и бромоводород в присутствии пероксида водорода
Б) циклопропан и бром
В) бензол и пропен в присутствии хлорида алюминия
Г) толуол и хлор в присутствии хлорида алюминия
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием вещества и признаком реакции, который наблюдается при взаимодействии вещества с аммиачным раствором оксида серебра: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ВЕЩЕСТВО
А) пропаналь
Б) пероксид водорода
В) соляная кислота
Г) иодид натрия
ПРИЗНАК РЕАКЦИИ
1) видимые признаки отсутствуют
2) образование белого осадка
3) образование жёлтого осадка
4) образование тёмного осадка
5) выделение газа
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: СтатГрад: Тренировочная работа 06.02.2023. Вариант ХИ2210301.
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием раствора жёлтого цвета. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми приводит к образованию слабого основания. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 2
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 2
Из предложенного перечня выберите все способа уменьшить скорость реакции разложения пероксида водорода в водном растворе.
1) разбавление раствора
2) охлаждение раствора
3) уменьшение давления над раствором
4) добавление катализатора
5) добавление пероксида водорода
Запишите в поле ответа номера выбранных способов.
Установите соответствие между уравнением реакции и свойством, которое проявляет пероксид водорода в этой реакции.
СВОЙСТВО ПЕРОКСИДА ВОДОРОДА
1) является окислителем
2) является восстановителем
3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в таблицу выбранные цифры под соответствующими буквами.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает без видимых изменений. Выделение газа и выпадение осадка в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора. Выделение газа и выпадение осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, не приводящая к выделению газа и выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ.
Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора. Выделение газа и выпадение осадка в ходе реакции не наблюдаются. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Показать
1
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выделению газа. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Задания Д29 № 139
При разложении 340 г пероксида водорода образуется ____ л (н. у.) кислорода. (Запишите число с точностью до целых)
1) 100
2) 110
3) 112
4) 124
Источник: Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Даны вещества: хлорид железа (III), оксид алюминия, гидроксид калия, пероксид водорода, иодид калия.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Порошок сульфида хрома (III) растворили в серной кислоте. При этом выделился газ и образовался окрашенный раствор. К полученному раствору добавили избыток раствора аммиака, а газ пропустили через раствор нитрата свинца. Полученный при этом чёрный осадок побелел после обработки его пероксидом водорода. Запишите уравнения описанных реакций.
Хром сожгли в хлоре. Полученная соль прореагировала с раствором, содержащим пероксид водорода и гидроксид натрия. К образовавшемуся жёлтому раствору добавили избыток серной кислоты, цвет раствора изменился на оранжевый. Когда с этим раствором прореагировал оксид меди (I), цвет раствора стал сине-зелёным.
Напишите уравнения четырёх описанных реакций.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2, ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3
Хром растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора карбоната натрия. Выделившийся осадок отфильтровали и растворили в избытке щёлочи. К полученному раствору добавили пероксид водорода, в результате чего раствор приобрёл жёлтый цвет. Напишите уравнения четырёх описанных реакций.
Вычислите объём газа, который выделится при взаимодействии 10 моль пероксида натрия с избытком углекислого газа. Ответ укажите в литрах с точностью до целых.
Источник: Эксперт в ЕГЭ. Под редакцией Медведева Ю. Н., Антошина А. Э., Лидина Р. А.
Над металлическим хромом при нагревании пропустили избыток хлора. Твердый продукт реакции растворили в воде и обработали необходимым количеством пероксида водорода в присутствии гидроксида натрия, в результате чего образовался раствор желтого цвета. К полученному раствору добавили серную кислоту. Образовавшееся при этом вещество оранжевого цвета выделили, растворили в разбавленном растворе серной кислоты и добавили оксид меди (I).
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Смешали раствор гидрокарбоната натрия и гидроксида натрия. К полученному раствору добавили бромид хрома (III), в результате чего выпал осадок и выделился бесцветный газ. Осадок при нагревании прореагировал с необходимым количеством пероксида водорода в присутствии гидроксида калия, в результате чего образовался раствор желтого цвета. Далее к раствору добавили серную кислоту, при этом раствор поменял цвет с желтого на оранжевый.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
Всего: 123 1–20 | 21–40 | 41–60 | 61–80 | 81–100 …
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + O2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Пероксид водорода прореагировал с оксидом серебра (I). Выделившийся газ пропустили через нагретую трубку, наполненную сульфидом цинка. Полученный в результате этой реакции остаток прореагировал с концентрированным раствором гидроксида натрия. Полученную соль прокалили.
Напишите уравнения четырёх описанных реакций.
Сведения для решения
1) Пероксид водорода проявляет восстановительные свойства в реакции с оксидом серебра, при этом выделяется кислород и образуется металлическое серебро:

2) Выделившийся кислород участвует в окислительно-восстановительной реакции с сульфидом серы, окисляя ее до диоксида:

3) Оксид цинка проявляет амфотерные свойства, реагируя с кислотами и щелочами. При растворении оксида цинка в концентрированном растворе щелочи образуются комплексные соли — тетрагидроксоцинкаты:
4) При прокаливании тетрагидроксоцинкаты, теряя воду, превращаются в цинкаты:
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут.
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr+3.
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2 → N2 + 6H2O
Соединения Cr+3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au+3, KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
Получение, строение и свойства пероксида водорода
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н+, а на аноде — HSО4—. Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н+ + 2
На аноде: 2HSО4— — 2
или 2H2SO4 = H2S2O8 + 2H+ + 2
Молекулярная форма:
2H2SO4 = H2S2O8 + Н2↑.
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4— . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2
На аноде: 2HSО4— — 2
Молекулярная форма:
2(NH4)HSO4 + 2H2O = H2S2O8 + 2NH4OH + H2↑.
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
H2S2O8 + 2Н2О = 2H2SO4 + Н2О2.
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Н2 + О2 = Н2О2.
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
2Н + О2 = Н2О2.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с 
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( 
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
2Н2О2 ⇔ 2Н2О + О2.
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Уравнения электронного баланса:
Ионно-молекулярная форма:
4О— = О20 + 2О2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10-3м3. Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Отсюда
Ответ: 2,02%.
- Дисциплина: Химия
- Номер вопроса в билете: 32
- Баллы: 4
- Сложность: Высокий
-
Газ, полученный при взаимодействии пероксида натрия с оксидом углерода(IV), прореагировал с раскалённым железом с образованием железной окалины. Полученное вещество растворили в концентрированной азотной кислоте, при этом наблюдали выделение газа. Образовавшуюся при этом соль выделили и добавили к раствору карбоната калия.
Напишите уравнения четырёх описанных реакций.
Данную задачу проверяют не автоматически, а вручную.
Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 4 баллов.
Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения.
Форма для оценки находится внизу страницы.Критерии оценки вопроса
Содержание верного ответа и указания по оцениванию Баллы Правильно записаны четыре уравнения реакций 4 Правильно записаны три уравнения реакций 3 Правильно записаны два уравнения реакций 2 Правильно записано одно уравнение реакции 1 Все элементы ответа записаны неверно 0 Максимальный балл 4 Подробное решение
Реакция взаимодействия пероксида натрия с оксидом углерода:
2 NaX2OX2+2 COX2=2 NaX2COX3+OX2↑ce{2Na2O2 + 2CO2 = 2Na2CO3 + O2 ^}
2 OX−−2 eX−→OX2X0 ∣ 22 OX−2+4 eX−→OX2X0 ∣ 1ce{ 2O^{-} — 2 $e$- -> O2^{0} | 2} \
ce{ 2O^{-2} +4 $e$- -> O2^{0} | 1}Газ, кислород, вступил в реакцию с раскаленным железом:
3 Fe+2 OX2→tXo2 FeX3OX4ce{3Fe + 2O2 ->[t^o] 2Fe3O4}
Реакция железной окалины с азотной кислотой:
FeX3OX4+10 HNOX3=3 Fe(NOX3)X3+NOX2↑+5 HX2Oce{Fe3O4 + 10 HNO3 = 3Fe(NO3)3 + NO2 ^ + 5H2O}
Выделили соль нитрат железа и добавили к раствору карбоната калия:
2 Fe(NOX3)X3+3 KX2COX3+3 HX2O=2 Fe(OH)X3↓+3 COX2↑+6 KNOX3ce{2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 v + 3CO2 ^ + 6KNO3}
Оцените своё решение
0
1
2
3
4
- Подробное решение
-
Реакция взаимодействия пероксида натрия с оксидом углерода:
2 NaX2OX2+2 COX2=2 NaX2COX3+OX2↑ce{2Na2O2 + 2CO2 = 2Na2CO3 + O2 ^}
2 OX−−2 eX−→OX2X0 ∣ 22 OX−2+4 eX−→OX2X0 ∣ 1ce{ 2O^{-} — 2 $e$- -> O2^{0} | 2} \
ce{ 2O^{-2} +4 $e$- -> O2^{0} | 1}Газ, кислород, вступил в реакцию с раскаленным железом:
3 Fe+2 OX2→tXo2 FeX3OX4ce{3Fe + 2O2 ->[t^o] 2Fe3O4}
Реакция железной окалины с азотной кислотой:
FeX3OX4+10 HNOX3=3 Fe(NOX3)X3+NOX2↑+5 HX2Oce{Fe3O4 + 10 HNO3 = 3Fe(NO3)3 + NO2 ^ + 5H2O}
Выделили соль нитрат железа и добавили к раствору карбоната калия:
2 Fe(NOX3)X3+3 KX2COX3+3 HX2O=2 Fe(OH)X3↓+3 COX2↑+6 KNOX3ce{2Fe(NO3)3 + 3K2CO3 + 3H2O = 2Fe(OH)3 v + 3CO2 ^ + 6KNO3}
- Войти в свой аккаунт
-
Химия
-
Биология
-
Русский язык
-
Математика базовая
-
Математика профильная