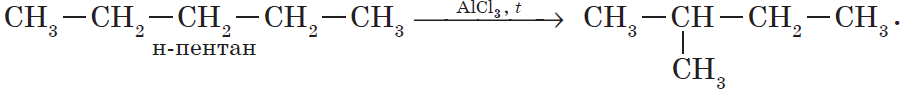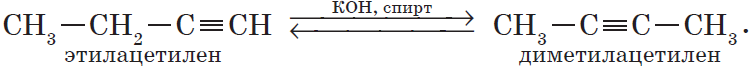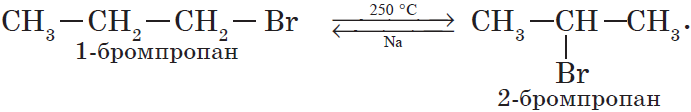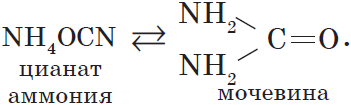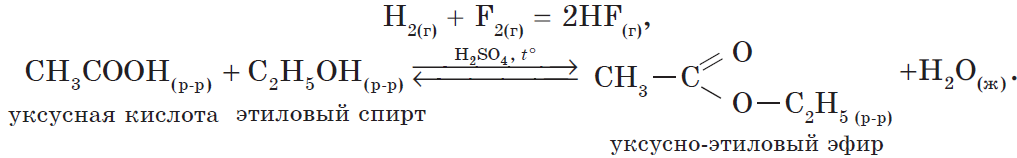Всего: 205 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Из предложенного перечня выберите все реакции, которые соответствуют взаимодействию оксида меди (II) с углеродом.
1) окислительно-восстановительная
2) разложения
3) замещения
4) соединения
5) обмена
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми вступает в реакцию замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми бензол вступает в реакцию замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми алюминий вступает в реакцию замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми бром вступает в реакцию замещения.
1) водород
2) этилен
3) бутан
4) бромид железа (II)
5) толуол
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 05.05.2015. Досрочная волна
Из предложенного перечня выберите все реакции замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все уравнения, которые описывают реакцию замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных уравнений.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми вступает в реакцию замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все вещества, с которыми бром вступает в реакцию замещения.
1) гексан
2) водород
3) магний
4) этилен
5) пропан
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 1
Из предложенного перечня выберите все вещества, с которыми бензол вступает в реакцию замещения.
1)
2) (на свету)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ
Из предложенного перечня выберите все пары веществ, каждая из которых даёт реакцию замещения.
1) этен и хлороводород
2) бензол и азотная кислота
3) ацетилен и вода
4) этилен и вода
5) метан и хлор
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 4
Из предложенного перечня выберите все пары веществ, каждая из которых даёт реакцию замещения.
1) ацетилен и бромоводород
2) пропан и хлор
3) этен и хлор
4) бензол и азотная кислота
5) этилен и хлороводород
Запишите в поле ответа номера выбранных веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 02.04.2016. Досрочная волна
Из предложенного перечня реакций выберите все реакции замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ
Взаимодействие оксида фосфора(V) с водой относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) обмена, экзотермическим
4) замещения, экзотермическим
Укажите эндотермическую реакцию соединения
1)
2)
3)
4)
Взаимодействие этанола с уксусной кислотой относится к реакциям
1) гидрогенизации
2) присоединения
3) этерификации
4) замещения
Взаимодействие метана с хлором относится к реакциям:
1) каталитическим
2) обратимым
3) гомогенным
4) присоединения
5) окислительно-восстановительным
Запишите номера выбранных типов реакций.
Из предложенного перечня выберите все реакции замещения.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных реакций.
Источник: РЕШУ ЕГЭ, Яндекс: Тренировочная работа ЕГЭ по химии. Вариант 2.
Из предложенного перечня выберите все пары веществ, каждая из которых даёт реакцию замещения.
1) хлороводород с пропаном
2) вода с ацетиленом
3) хлор с этеном
4) бензол с азотной кислотой
5) хлор с этаном
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 2
Из предложенного перечня выберите все пары веществ, каждая из которых даёт реакцию замещения.
1) бромоводород с ацетиленом
2) бром с пропаном
3) вода с этиленом
4) бензол с хлорметаном
5) хлор с этеном
Запишите в поле ответа номера выбранных пар веществ.
Источник: РЕШУ ЕГЭ, ЕГЭ по химии 24.04.2014. Досрочная волна. Вариант 3
Всего: 205 1–20 | 21–40 | 41–60 | 61–80 …
1.4.1. Классификация химических реакций в неорганической и органической химии.
Классификация химических реакций на основании их признаков.
Классификационный признак |
Тип реакции |
Число и состав реагентов и продуктов |
соединенияв результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
разложенияв таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu
|
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O
|
|
Изменение степеней окисления химических элементов |
окислительно-восстановительныев результате таких реакций изменяются степени окисления одного или более химических элемента. Например: |
Реакции, протекающие с сохранением степеней окисления атомов всех химических элементов |
|
Обратимость |
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
Тепловой эффект |
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
Количество фаз |
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.: |
|
По участию катализатора |
каталитическиереакции, протекающие в присутствии катализатора:
|
некаталитическиереакции, протекающие без катализатора: |
Классификация химических реакций в органической химии:
Реакции присоединения |
В зависимости от того, какое соединение присоединяется органическим веществом различают:
Гидрирование — присоединение водорода:Гидратация — присоединение воды:Гидрогалогенирование — присоединение галогеноводорода:
|
Реакции замещения |
Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов:Нитрование углеводородов:Реакция спиртов с галогеноводородными кислотами:C2H5OH + HBr = C2H5Br + H2O и т.д. |
Реакции отщепления (элиминирования) |
Все реакции, в названии которых присутствует приставка «де-«: дегидрирование:дегидратация:дегидрогалогенирование:(от исходной молекулы бромэтана отщепляется бромоводород, который нейтрализуется щелочью) дегалогенирование:Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. Например, крекинг алканов, уравнение которого в общем виде можно записать как: |
Окислительно-восстановительные реакции |
Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединенияВ таких реакциях отдельные атомы углерода повышают свою степень окисления. Например: Восстановление органического соединенияЧаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
Реакции с сохранением качественного и количественного состава веществ |
Изомеризация |
Реакции протекающие по тем или иным механизмам |
Реакции протекающие по ионному механизмуВ таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизму протекают такие реакции как:
|
Реакции протекающие по радикальному механизмуВ таких реакциях активными действующими частицами являются свободные радикалы:
|
За это задание ты можешь получить 1 балл. На решение дается около 2 минут. Уровень сложности: базовый.
Средний процент выполнения: 61%
Ответом к заданию 17 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Задача 1
Из предложенного перечня выберите две группы веществ, каждое вещество в которых может вступать в реакции замещения.
- ацетилен, гексахлоран, бензол
- хлорпропан, пропин, тетрафторэтилен
- бромбутан, пропин, циклогексан
- этилен, этан, ацетальдегид
- метиламин, анилин, ацетон
Запишите в поле ответа номера выбранных групп веществ.
Решение
Реакции замещения характерны для алканов, в них вступают вещества, имеющие участки предельных углеводородных цепочек. Также в реакции замещения вступают арены. В первой строке в реакцию замещения не вступает ацетилен, во второй — тетрафторэтилен, в четвёртой — этилен. Вещества, находящиеся в третьей и пятой строчках вступают в реакции замещения.
Ответ: 35
Задача 2
Из предложенного перечня выберите два вещества, взаимодействие которых с водой относится к обратимым реакциям.
- оксид калия
- оксид серы(IV)
- натрий
- гидрид лития
- этилформиат
Запишите в поле ответа номера выбранных веществ.
Решение
С водой обратимо реагируют оксиды неметаллов, дающие слабые кислоты, которые разлагаются на оксид и воду (сернистая, угольная и др.), а также сложные эфиры — реакция этерификации обратима. Среди представленных веществ есть оксид серы (IV), обратимо реагирующий с водой с образованием сернистой кислоты и этилформиат — сложный эфир.
Ответ: 25
Задача 3
К каким двум из перечисленных типов реакций относится взаимодействие железа с хлоридом меди(II)?
- каталитическим
- обратимым
- обмена
- замещения
- окислительно-восстановительным
Запишите в поле ответа номера выбранных типов реакций.
Решение
Реакции соединения — реакции, в которых из нескольких веществ образуется одно новое вещество:
Ca + S = CaS
$4NO_2 + O_2 + 2H_2O = 4HNO_3$
$CO_2 + CaO = CaCO_3$
Реакции разложения — реакции, в которых из одного вещества образуется несколько новых веществ:
$CaCO_3 = CaO + CO_2$
$2Cu(NO_3)_2 = 2CuO + 4NO_2 + O_2$
Реакции замещения — реакции, в которых атом или группа атомов, входящих в состав одного вещества, замещает(-ют) атом или группу атомов в молекуле другого вещества:
$Zn + 2HCl = ZnCl_2 + H_2$
$SiO_2 + CaCO_3 = CaSiO_3 + CO_2$
Реакции обмена — реакции, в которых сложные вещества обмениваются своими составными частями:
$H_2SO_4 + CaO = CaSO_4 + H_2O$
$CuCl_2 + 2NaOH = Cu(OH)_2 + 2NaCl$
Необратимые реакции протекают в одном направлении до полного расходования исходных веществ. Условия необратимости — удаление одного из продуктов реакции из сферы реакции (в виде осадка, газа, воды или другого слабого электролита) или выделение большого количества теплоты:
$HCl + AgNO_3 = AgCl↓ + HNO_3$
$2HCl + FeS = FeCl_2 + H_2S↑$
$HCl + NaOH = NaCl + H_2O$
$HCl + CH_3COONa = NaCl + CH_3COOH$
$C + O_2 = CO_2 + Q$
Обратимые реакции — одновременно могут протекать и прямая, и обратная реакция; в системе находятся и исходные вещества (реагенты), и продукты реакции:
$CO_2 + H_2O ⇄ H_2CO_3$
Экзотермические реакции — реакции, сопровождающиеся выделением теплоты (обозначают знаком +Q в уравнении реакции):
$2CO + O_2 = 2CO_2 + Q$
Эндотермические реакции — реакции, сопровождающиеся поглощением тепла (обозначаются знаком –Q в уравнении реакции):
$CaCO_3 = CaO + CO_2 – Q$
Окислительно-восстановительные реакции — реакции, в которых происходит изменение степени окисления элементов:
$C^{0} + O_2^{0} = C^{+4}O_2^{–2}$
Составляем уравнение реакции взаимодействия железа с хлоридом меди(II):
$Fe^{0} + Cu^{+2}Cl_2 = Fe^{+2}Cl_2 + Cu^0$
Реакция — замещения (атомы цинка замещают атомы меди в молекуле сложного вещества), окислительно-восстановительная (изменяются степени окисления цинка и меди), необратимая (образуется нерастворимое вещество медь).
Вывод: правильные ответы 4, 5.
Ответ: 45
Задача 4
Из предложенного перечня выберите два вещества, взаимодействие которых с бромоводородной кислотой не является окислительно-восстановительной реакцией.
- аммиак
- железо
- хлор
- оксид свинца(IV)
- оксид бария
Запишите в поле ответа номера выбранных веществ.
Решение
Окислительно-восстановительной реакцией не является взаимодействие с бромоводородной кислотой аммиака и оксида бария.
Ответ: 15
Задача 5
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие цинка с соляной кислотой.
- необратимая
- каталитическая
- обратимая
- обмена
- окислительно-восстановительная
Запишите в поле ответа номера выбранных типов реакций.
Решение
Реакция цинка с соляной кислотой протекает по следующему уравнению: $Zn + 2HCl = ZnCl_2 + H_2$
Реакция необратима, так как обратно водород вытеснить цинк из соли не сможет, протекает без катализатора — некаталитическая, цинк замещает водород соляной кислоты, следовательно, реакция замещения. Элементы в реакции меняют степени окисления, следовательно, это окислительно-восстановительная реакция.
Ответ: 15
Задача 6
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие оксида кремния(IV) с карбонатом калия.
- необратимая
- обратимая
- обмена
- замещения
- гомогенная
Запишите в поле ответа номера выбранных типов реакций.
Решение
Взаимодействие оксида кремния(IV) с карбонатом калия протекает по следующему уравнению: $SiO_2 + K_2CO_3 = K_2SiO_3 + CO_2$ Данная реакция необратима, так как обратно углекислый газ не вытеснит оксид кремния из соли. Оксид, взаимодействуя с солью, вытесняет из неё другой оксид — реакция замещения.
Ответ: 14
Задача 7
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести реакцию получения аммиака в промышленности.
- необратимая
- каталитическая
- обратимая
- обмена
- замещения
Запишите в поле ответа номера выбранных типов реакций.
Решение
В промышленности аммиак получают следующей реакцией: $N_2 + 3H_2 = 2NH_3$
Реакция протекает в присутствии катализатора, следовательно, она каталитическая. Аммиак способен разлагаться на водород и азот, то есть возможна обратная реакция. Реакция синтеза аммиака обратима.
Ответ: 23
Задача 8
Из предложенного перечня выберите все уравнения реакций, которые соответствуют реакции нейтрализации.
- $2NaОН + FeSO_4 = Fe(OH)_2 + Na_2SO_4$
- $H_2SO_4 + Ba(OH)_2 = BaSO_4 + 2H_2O$
- $Mg(NO_3)_2 + 2NaOH = Mg(OH)_2 + 2NaNO_3$
- $BaBr_2 + Na_2SO_4 = BaSO_4 + 2NaBr$
- $Ca(OH)_2 + 2HCl = CaCl_2 + 2H_2O$
Запишите в поле ответа номера выбранных реакций.
Решение
Реакции нейтрализации – реакция взаимодействия кислоты и основания, поэтому подходят реакции 2 и 5.
Ответ: 25
Задача 9
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие меди с раствором нитрата серебра.
- реакция обмена
- каталитическая реакция
- обратимая реакция
- реакция замещения
- гетерогенная реакция
Запишите в поле ответа номера выбранных типов реакций.
Решение
$Сu + 2AgNO_3 = Cu(NO_3)_2 +2Ag$
Медь, как более активный металл, вытесняет серебро из соли — происходит реакция замещения. Поскольку твёрдое вещество (медь) реагирует с жидким (раствором нитрата серебра), эта реакция гетерогенна.
Ответ: 45
Задача 10
Из предложенного перечня выберите две химические реакции, которые можно отнести как к окислительно-восстановительным реакциям, так и к реакциям разложения.
- $CaCO_3 = CaO + CO_2$
- $2Fe(OH)_3 = Fe_2O_3 + 3H_2O$
- $2HgO = 2Hg + O_2$
- $C + O_2 = CO_2$
- $3HClO = 2HCl + HClO_3$
Запишите в поле ответа номера выбранных реакций.
Решение
Реакции разложения – реакции, при которых одно сложное вещество разлагается на несколько других. ОВР – реакции, в которых присутствует окислитель и восстановитель, то есть атомы элементов, которые в ходе реакции меняют свою степень окисления. Все реакции, кроме 4, разложение, но только в 3 и 5 меняют свои степени окисления ртуть и кислород в первом случае и хлор (он является и окислителем, и восстановителем) в другом случае.
Ответ: 35
Задача 11
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести взаимодействие хлора с водой при обычных условиях.
- необратимые реакции
- обратимые реакции
- реакции замещения
- реакции диспропорционирования
- внутримолекулярные окислительно-восстановительные реакции
Запишите в поле ответа номера выбранных типов реакций.
Решение
$Cl_2 + H_2O ⇌ HCl + HClO$ При растворении в воде хлор диспропорционирует, образуя хлорноватистую и соляную кислоты, при этом реакция обратима.
Ответ: 24
Задача 12
Из предложенного перечня выберите все химические реакции, которые относятся к реакциям замещения.
- соляная кислота с гидроксидом бария
- оксид кремния с кальцинированной содой
- толуол с хлором
- этилен с хлором
- соляная кислота с каустической содой
Запишите в поле ответа номера выбранных реакций.
Решение
Оксид кремния замещает в карбонате кальция карбонат, выделяется углекислый газ.
Также замещение – это реакция толуола с хлором, замещение водорода в метильном радикале на хлор.
Ответ: 23
Задача 13
Из предложенного перечня выберите две реакции, которые можно отнести к реакциям диспропорционирования.
- взаимодействие железа с соляной кислотой
- взаимодействие серы с концентрированной азотной кислотой
- взаимодействие брома с водой
- взаимодействие серы с углеродом
- взаимодействие фосфора с гидроксидом калия
Запишите в поле ответа номера выбранных реакций.
Решение
Реакциями диспропорционирования называют те реакции, в которых один элемент является и окислителем, и восстановителем, его степень окисления в одном из продуктов выше исходной, а в другом — ниже. Такие реакции характерны для взаимодействия простых веществ неметаллов с водой и с щелочами, поэтому подходят варианты 3 (бром реагирует с водой) и 5 (взаимодействие фосфора с гидроксидом калия).
Ответ: 35
Задача 14
Из предложенного перечня химических реакций выберите две реакции, которые можно отнести к необратимым.
- $(NH_4)_2SO_4 + 2HCl = 2NH_4Cl + H_2SO_4$
- $2NH_4Cl + Ba(NO_3)_2 = 2NH_4NO_3 + BaCl_2$
- $NH_4NO_3 + KOH = NH_3 · H_2O + KNO_3$
- $NaCl + CH_3COOK = KCl + CH_3COONa$
- $CH_3COONa + HNO_3 = CH_3COOH + NaNO_3$
Запишите в поле ответа номера выбранных реакций.
Решение
Реакции ионного обмена, к которым относятся все приведённые реакции, необратимы тогда, когда среди продуктов есть осадки, газы, или если более сильная кислота или основание вытесняют из соли менее сильную кислоту или основание. В реакции 3 в продуктах есть неустойчивый гидрат аммиака $NH_3 · H_2O$, распадающийся на аммиак (газ) и воду. В реакции 5 сильная азотная кислота вытесняет из соли слабую уксусную, реакция необратима.
Ответ: 35
Задача 15
Из предложенного перечня типов химических реакций выберите два типа реакций, к которым можно отнести взаимодействие оксида цинка с карбонатом натрия.
- необратимая реакция
- обратимая реакция
- реакция обмена
- реакция замещения
- окислительно-восстановительная реакция
Запишите в поле ответа номера выбранных типов реакций.
Решение
$ZnO + Na_2CO_3 = Na_2 ZnO_2 + CO_2$ – образование цинката натрия и углекислого газа. Реакция замещения, необратима.
Ответ: 14
Задача 16
Из предложенного перечня химических реакций выберите две реакции, которые имеют радикальный механизм.
- бутилен и вода
- бутан и бром
- бутилен и бромоводород
- пропилен и бензол
- горение пропилена
Запишите в поле ответа номера выбранных реакций.
Решение
Присоединение к алкенам различных веществ (воды, галогенов, галогенводородов) по двойной связи происходит не по радикальному механизму, а по ионному. Радикальный механизм имеют реакции галогенирования алканов, а также реакции горения. Алкан (бутан) и галоген (бром) находятся под номером 2, горение представлено в пункте 5.
Ответ: 25
Задача 17
Из предложенного перечня выберите два типа химических реакций, к которым можно отнести реакцию обжига известняка.
- окислительно-восстановительная реакция
- обратимая реакция
- эндотермическая реакция
- реакция соединения
- экзотермическая реакция
Запишите в поле ответа номера выбранных типов реакций.
Решение
Обжиг известняка — это его разложение, значит, реакция эндотермическая, так как требует теплоты, также реакция является частично обратимой, так как два образовавшихся оксида могут обратно взаимодействовать.
Ответ: 23
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
$↙{13}↖{27}{Al}+ {}↙{1}↖{1}{H}={}↙{12}↖{24}{Mg}+{}↙{2}↖{4}{He}$
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
$С_{(графит)}⇄С_{(алмаз)}$
$S_{(ромбическая)}⇄S_{(моноклинная)}$
$Р_{(белый)}⇄Р_{(красный)}$
$Sn_{(белое олово)}⇄Sn_{(серое олово)}$
$3О_{2(кислород)}⇄2О_{3(озон)}$.
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
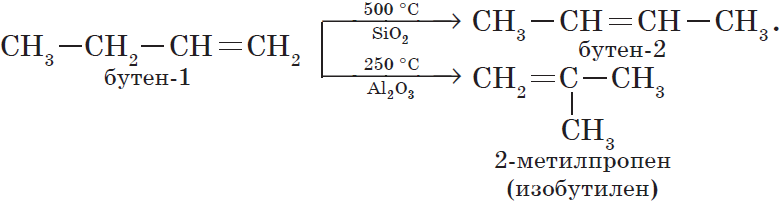
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
$2SO_2+O_2{⇄}↖{t,p,кат.}2SO_3$ — из простого и сложного веществ образуется одно сложное;
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
$4NO_2+O_2+2H_2O=4HNO_3$.
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
$CH_2{=}↙{этен}CH_2+H_2{→}↖{Ni,t°}CH_3{-}↙{этан}CH_3;$
2) реакция гидратации — присоединение воды:
$CH_2{=}↙{этен}CH_2+H_2O{→}↖{H_3PO_4,t°}{C_2H_5OH}↙{этанол};$
3) реакция полимеризации:
${nCH_2=CH_2}↙{этилен}{→}↖{p,кат.,t°}{(-CH_2-CH_2-)_n}↙{полиэтилен}$
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO{→}↖{t°}2Hg+O_2↑$ — из одного сложного вещества образуются два простых;
2) разложение нитрата калия:
$2KNO_3{→}↖{t°}2KNO_2+O_2↑$ — из одного сложного вещества образуются одно простое и одно сложное;
3) разложение перманганата калия:
$2KMnO_4{→}↖{t°}K_2MnO_4+MnO_2+O_2↑$ — из одного сложного вещества образуются два сложных и одно простое, т.е. три новых вещества.
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
$C_2H_5OH{→}↖{H_2SO_4,t°}CH_2=CH_2+H_2O;$
2) реакция дегидрирования (отщепления водорода) этана:
$CH_3—CH_3{→}↖{Cr_2O_3,500°C}CH_2=CH_2+H_2↑;$
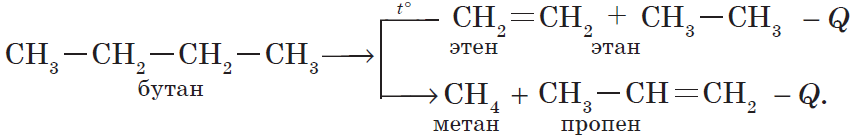
3) реакция крекинга (расщепления) пропана:
$CH_3-CH_2CH_3{→}↖{t°}CH_2=CH_2+CH_4↑.$
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
$2Na+2H_2O=2NaOH+H_2↑$
2) взаимодействие металлов с кислотами в растворе:
$Zn+2HCl=ZnCl_2+H_2↑$;
3) взаимодействие металлов с солями в растворе:
$Fe+CuSO_4=FeSO_4+Cu;$
4) металлотермия:
$2Al+Cr_2O_3{→}↖{t°}Al_2O_3+2Cr$.
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
$CH_4+Cl_2{→}↖{hν}{CH_3Cl}↙{хлорметан}+HCl$,
$CH_3Cl+Cl_2→{CH_2Cl_2}↙{дихлорметан}+HCl$,
$CH_2Cl_2+Cl_2→{CHCl_3}↙{трихлорметан}+HCl$,
$CHCl_3+Cl_2→{CCl_4}↙{тетрахлорметан}+HCl$.
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
$C_6H_6Br_2{→}↖{FeBr_3}{C_6H_5Br}↙{бромбензол}+HBr$.
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
$C_6H_6+{HNO_3}↙{бензол}{→}↖{H_2SO_4(конц.),t°}{C_6H_5NO_2}↙{нитробензол}+H_2O$
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Эти реакции характеризуют свойства электролитов и в растворах протекают по правилу Бертолле, т.е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например, $Н_2О$).
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
$NaOH+HNO_3=NaNO_3+H_2O$
или в ионном виде:
$OH^{–}+H^{+}=H_2O$;
2) реакция между щелочью и солью, идущая с образованием газа:
$2NH_4Cl+Ca(OH)_2=CaCl_2+2NH_3↑+2H_2O$
или в ионном виде:
$NH_4^{+}+OH^{–}=NH_3↑+H_2O$;
3) реакция между щелочью и солью, идущая с образованием осадка:
$CuSO_4+2KOH=Cu(OH)_2↓+K_2SO_4$
или в ионном виде:
$Cu^{2+}+2OH^{-}=Cu(OH)_2↓$
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
1) реакция, идущая с образованием слабого электролита — $H_2O$:
$CH_3COOH+NaOH⇄NaCH_3COO+H_2O$
или
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$;
2) реакция, идущая с образованием газа:
$2CH_3COOH+CaCO_3=2CH_3COO^{–}+Ca^{2+}+CO_2↑+H_2O$;
3) реакция, идущая с образованием осадка:
$2CH_3COOH+K_2SiO_3=2KCH_3COO+H_2SiO_3↓$
или
$2CH_3COOH+SiO_3^{−}=2CH_3COO^{−}+H_2SiO_3↓$.
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
1.${Mg}↖{0}+{2H}↖{+1}+SO_4^{-2}={Mg}↖{+2}SO_4+{H_2}↖{0}↑$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}$
${{2H}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{H_2}↖{0}$
2.${2Mg}↖{0}+{O_2}↖{0}={2Mg}↖{+2}{O}↖{-2}$
${{Mg}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Mg}↖{+2}|4|2$
${{O_2}↖{0}+4{e}↖{-}}↙{окислитель}{→}↖{восстановление}{2O}↖{-2}|2|1$
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
${2Fe}↖{0}+6H_2{S}↖{+6}O_{4(k)}={Fe_2}↖{+3}(SO_4)_3+3{S}↖{+4}O_2+6H_2O$
${{Fe}↖{0}-3{e}↖{-}}↙{восстановитель}{→}↖{окисление}{Fe}↖{+3}|2$
${{S}↖{+6}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{S}↖{+4}|3$
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{H_2}↖{0}}↙{text»уксусный альдегид»}{→}↖{Ni,t°}{CH_3-{C}↖{-1}{H_2}↖{+1}{O}↖{-2}{H}↖{+1}}↙{text»этиловый спирт»}$
${{C}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}{C}↖{-1}|1$
${{H_2}↖{0}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}2{H}↖{+1}|1$
2. Альдегиды окисляются в соответствующие кислоты:
${CH_3-{C}↖{+1} {}↖{O↖{-2}}↙{H↖{+1}}+{Ag_2}↖{+1}{O}↖{-2}}↙{text»уксусный альдегид»}{→}↖{t°}{CH_3-{Ag}↖{0}{C}↖{+3}{O}↖{-2}{OH}↖{-2+1}+2{Ag}↖{0}↓}↙{text»этиловый спирт»}$
${{C}↖{+1}-2{e}↖{-}}↙{восстановитель}{→}↖{окисление}{C}↖{+3}|1$
${2{Ag}↖{+1}+2{e}↖{-}}↙{окислитель}{→}↖{восстановление}2{Ag}↖{0}|1$
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
- многие реакции соединения:
$Li_2O+H_2O=2LiOH;$
- многие реакции разложения:
$2Fe(OH)_3{→}↖{t°}Fe_2O_3+3H_2O;$
- реакции этерификации:
$HCOOH+CH_3OH⇄HCOOCH_3+H_2O$.
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Экзотермические реакции.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
$N_2+O_2=2NO – Q$,
$H_{2(г)}+I{2(т)}=2HI – Q$.
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
$4P+5O_2=2P_2O_5+Q,$
$CH_4+2O_2=CO_2+2H_2O+Q$.
Гидрирование этилена — пример экзотермической реакции:
$CH_2=CH_2+H_2{→}↖{Pt}CH_3-CH_3+Q$
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
$CaCO_3{→}↖{t°}CaO+CO_2↑-Q;$
б) крекинг бутана:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
$H_{2(г)}+Cl_{2(г)}=2HCl_{(г)}+92.3 кДж,$
$N_{2(г)}+О_{2(г)}=2NO_{(г)} – 90.4 кДж$.
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Гетерогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
$2Al_{(т)}+3CuCl_{2(р-р)}=3Cu_{(т)}+2AlCl_{3(р-р)}$,
$СаС_{2(т)}+2Н_2О_{(ж)}=С_2Н_2↑+Са(ОН)_{2(р-р)}$.
Гомогенные реакции.
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции.
Некаталитические реакции идут без участия катализатора:
$2HgO{→}↖{t°}2Hg+O_2↑$,
$C_2H_4+3O_2{→}↖{t°}2CO_2+2H_2O$.
Каталитические реакции.
Каталитические реакции идут с участием катализатора:
$2KClO_3{→}↖{MnO_2,t°}2KCl+3O_2↑,$
${C_2H_5OH}↙{этанол}{→}↖{H_2SO-4,t°}{CH_2=CH_2}↙{этен}↑+H_2O$
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более $70%$ химических производств используют катализаторы.
Классификация химических реакций по направлению
Необратимые реакции.
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
- гедрирование — дегидрирование;
- гидратация — дегидратация;
- полимеризация — деполимеризация.
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.