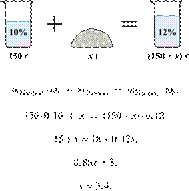
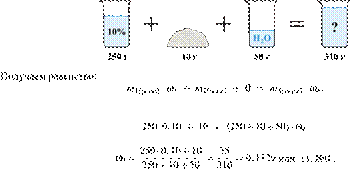
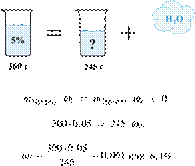
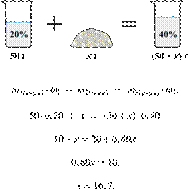
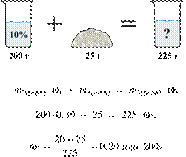
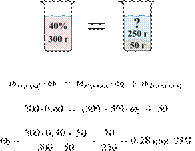
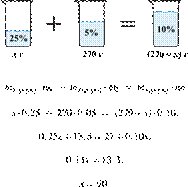
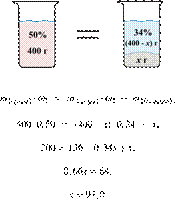
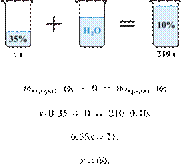
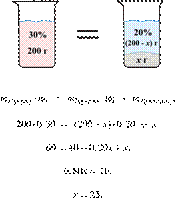
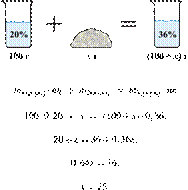
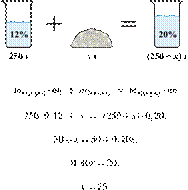
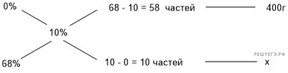При охлаждении 400 г горячего 50%-го раствора нитрата калия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка, если раствор над осадком содержал 34% нитрата калия по массе? Ответ дайте в граммах и округлите до ближайшего целого числа.
Спрятать решение
Решение.
Масса раствора, масса растворённого вещества и массовая доля растворённого вещества связаны соотношением:
При охлаждении раствора, сопровождающегося кристаллизацией, суммарная масса соли не изменяется.
Получаем равенство:
Ответ просят дать с точностью до целых.
Ответ: 97 г.
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
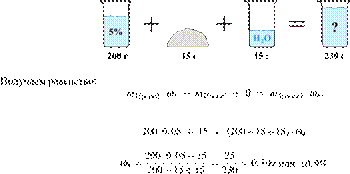
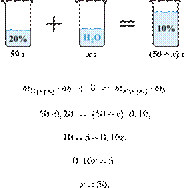
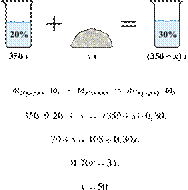
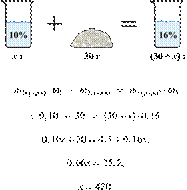
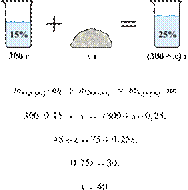
Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Центр. Вариант 5
2
Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
Источник: Демонстрационная версия ЕГЭ—2016 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ—2015 по химии, Демонстрационная версия ЕГЭ—2023 по химии
3
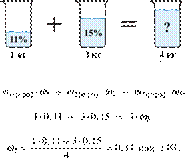
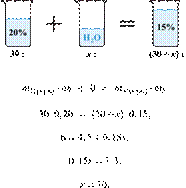
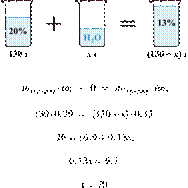
Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
4
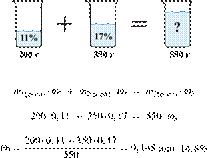
Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
5
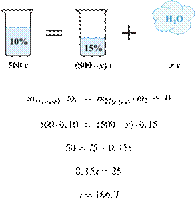
Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.
Пройти тестирование по этим заданиям
Задания
для подготовки
1. Задание 27 № 3265
Смешали 80 г
раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с
массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 28%.
1/59
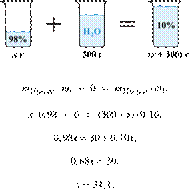
2. 4767
массу нитрата
калия (в граммах), который следует растворить в 150 г раствора с массовой долей
этой соли 10 % для получения раствора с
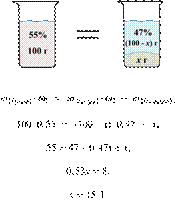
массовой долей 12 %. Ответ дайте точностью до десятых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 3,4 г.
2/59
3. 6248
Вычислите массовую долю
соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг
15%-ного раствора соли. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 14%.
3/59
4. 6249
Смешали 200 г
11%-ного раствора нашатыря и 350 г 17%-ного раствора этой же соли. Вычислите
массовую долю нашатыря в полученном
растворе. Ответ укажите в процентах с
точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 14,8%.
4/59
5. 6250
Упариванием 500 г
раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %.
Вычислите массу выпаренной при этом воды. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 143 г.
5/59
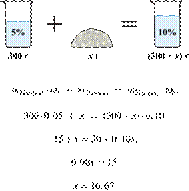
6. 6251
массу едкого натра,
который следует растворить в 300 г 5%-го раствора для получения 10%-го раствора
Ответ
укажите в граммах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
щелочи не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 16,7 г.
6/59
7. 6252
К 250 г 10%-го
раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Вычислите
массовую долю нитрата натрия в полученном
растворе. Ответ дайте в процентах с точностью до
десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 11,3%.
7/59
8. 6253
К 200 г 5%-ного
раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды.
Вычислите массовую долю хлорида аммония в полученном растворе. Ответ дайте в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
целых.
Ответ: 11%.
8/59
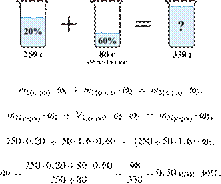
9.
6254
К 250 г 20%-ной
серной кислоты добавили 50 мл 60%-ной кислоты (плотностью 1,6 г/мл). Вычислите
массовую долю кислоты в полученном растворе. Ответ дайте в процентах с
точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 30%.
10.
Задание 27 № 6255
Вычислите массу
уксусной кислоты в растворе, полученном при смешивании 155 г 5%-го и 207 г
11%-го растворов кислоты. Ответ дайте в граммах с
точностью до десятых.
Решение.
Найдём массу кислоты:
Ответ: 30,5.
9/59
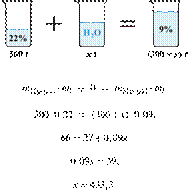
11. 6256
массу воды,
которую следует добавить к 300 г 22%-го раствора уксусной кислоты, чтобы
получить 9%-й раствор. Ответ дайте в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 433 г.
10/59
12. 6257
При упаривании 300
г 5%-го раствора сахарозы получены 245 г раствора. Вычислите массовую долю
сахарозы в нём. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
11/59
13. 6394
К 400 г 10%-го
раствора соли добавили 50 г этой же соли. Вычислите массовую долю соли в полученном
растворе. Ответ дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 20%.
12/59
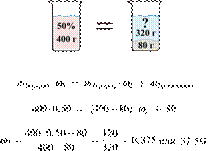
14. 6434
Из 400 г горячего
50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите
массовую долю соли в растворе над осадком.
Ответ дайте в процентах с точностью до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 37,5%.
13/59
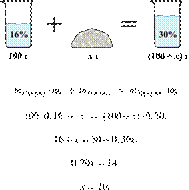
15. 6474
массу карбоната
калия, который надо прибавить к 100 г 16%-го раствора, чтобы получить 30%-й
раствор. Ответ представьте в граммах с точностью до
целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
14/59
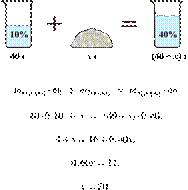
16. 6514
массу гидроксида
калия, который надо прибавить к 40 г 10%-го раствора, чтобы получить 40%-й
раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 20 г.
15/59
17. 6551
массу воды нужно
добавить к 50 г 20%-го раствора соляной кислоты, чтобы уменьшить её
концентрацию до 10 %. Ответ укажите в
граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50 г.
16/59
18. 6552
массу воды,
которую нужно добавить к 30 г 20%-го раствора гидроксида натрия, чтобы
понизить его концентрацию до 15 %. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 10 г.
17/59
19. 6553
массу воды нужно
испарить из 500 г 10%-го раствора гидроксида натрия, чтобы
увеличить его концентрацию в 1,5 раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 167 г.
18/59
20. 6554
массу воды, которую
нужно испарить из 300 г 15 %-го раствора гидроксида калия, чтобы
увеличить его концентрацию в два раза. Ответ
укажите в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При упаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 150 г.
19/59
21. 6555
массу соли нужно
добавить к 50 г 20%-го раствора, чтобы увеличить её концентрацию в два
раза. Ответ укажите в граммах с точностью до
целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 17 г.
20/59
22. 6611
К 300 г 10%-го
раствора гидроксида натрия добавили 60 г чистого гидроксида натрия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ укажите в
процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида натрия не изменяется.
Получаем равенство:
Ответ: 25%.
21/59
23. 6651
К 200 г 10%-го
раствора гидроксида калия добавили 25 г чистого гидроксида калия. Вычислите
массовую долю растворённого вещества в полученном растворе. Ответ
укажите в процентах с точностью до целых. Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
22/59
24. 6691
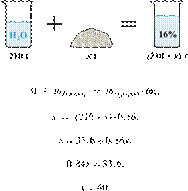
Вычислите массу
твёрдого нитрата аммония, который надо добавить к 210 г воды, чтобы получить
16%-й раствор соли. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора, масса
растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса соли не
изменяется.
Получаем равенство:
Ответ: 40 г.
23/59
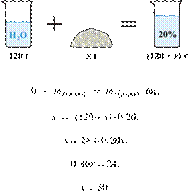
25. 6731
массу твёрдого
гидроксида калия, который надо добавить к 120 г воды, чтобы получить 20%-й
раствор щёлочи. Ответ укажите в граммах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении масса гидроксида
калия не изменяется.
Получаем равенство:
Ответ: 30 г.
24/59
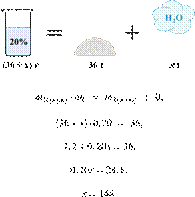
26. 6780
К 240 г раствора с
массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в
полученном растворе. Ответ дайте в процентах с
точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 6%.
25/59
27. 6820
При выпаривании
25%-го водного раствора получено 60 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 180 г.
26/59
28. 6860
При выпаривании
20%-го водного раствора получено 36 г сухого вещества. Вычислите массу
испарившейся воды. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При выпаривании раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 144 г.
27/59
29. 9640
массу гидроксида калия, который
необходимо растворить в 150 г воды для получения раствора с массовой долей
щёлочи 25 %. Ответ дайте в граммах с точностью до целых. Решение.
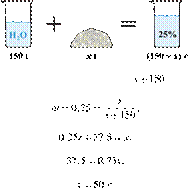
—
масса гидроксида калия (вещества), тогда — масса раствора, а —
(омега) массовая доля вещества, равная 25 % или 0,25. Имеем:
Ответ: 50.
28/59
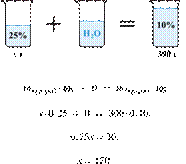
30. 9681
Растворяя соль в горячей воде, приготовили
300 г 40%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ
дайте в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 28%.
29/59
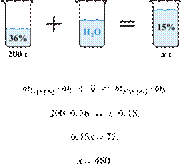
31. 9714
Вычислите массу
15%-го раствора вещества, который можно получить разбавлением 200 г 36%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 480 г.
30/59
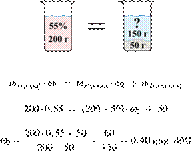
32. 9749
Растворяя соль в горячей воде, приготовили
200 г 55%-го раствора. При охлаждении раствора из него выпало 50 г осадка
безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте
в процентах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 40%.
31/59
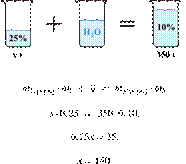
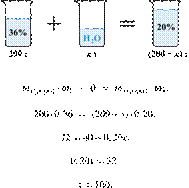
33. 9783
Разбавлением 25%-го
раствора вещества получили 350 г 10%-го раствора. Вычислите массу 25%-го
раствора. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 140 г.
32/59
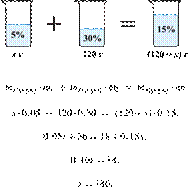
34. 9820
Сколько граммов 25%-го раствора вещества
надо добавить к 270 г 5%-го раствора, чтобы получить
10%-й раствор? (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 90.
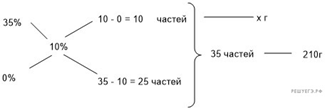
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 5 частей 25%-го раствора и 15 частей 5%-го
раствора. Составив пропорцию, получаем:
Ответ: 90.
33/59
35. 9854
Вычислите массу
5%-го раствора вещества, который надо добавить к 120 г 30%-го раствора, чтобы
получить 15%-й раствор. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 180 г.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для приготовления
15%-го раствора нужно 10 частей 30%-го раствора и 15 частей 5%-го раствора.
Составив пропорцию, получаем:
Ответ: 180 г.
34/59
36. 9888
Вычислите массу
воды, которую надо добавить к 200 г 36%-й соляной кислоты, чтобы получить 20%-ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 160 г.
35/59
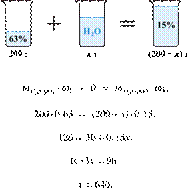
37. 9922
Вычислите массу
воды, которую надо добавить к 200 г 63%-й азотной кислоты, чтобы получить 15%ю
кислоту. Ответ дайте в граммах с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 640 г.
36/59
38. 10403
В 100 г 5%-го
раствора хлорида натрия растворили ещё 25 г этого вещества. Чему равна массовая
доля хлорида натрия (в %) в новом растворе? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 24%.
37/59
39.
10442
В 200 г 10%-го
раствора гидроксида калия растворили ещё 25 г этого вещества. Чему равна
массовая доля гидроксида калия (в %) в новом растворе? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 20%.
40.
Задание 27 № 10673
Сколько граммов 98%-ной серной кислоты
надо добавить к 300 г воды, чтобы получить 10%-ный раствор кислоты? Ответ
округлите до ближайшего целого числа.
38/59
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 34.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 98%-го раствора и 88 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 34.
39/59
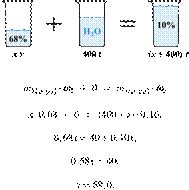
41. 10708
Сколько граммов
68%-ной азотной кислоты надо добавить к 400 г воды, чтобы получить 10%-ный
раствор кислоты? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 69.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 68%-го раствора и 58 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 69.
40/59
42. 11088
К 75 г раствора с
массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите
массовую долю соли в полученном растворе (в процентах). (Запишите число с
точностью до десятых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Ответ просят дать с точностью до
десятых.
Ответ: 21,6%.
41/59
43. 11168
При охлаждении 400
г горячего 50%-го раствора нитрата калия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 34% нитрата калия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 97 г.
42/59
44. 11233
При охлаждении 100
г горячего 55%-го раствора нитрата натрия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка (в г), если раствор над
осадком содержал 47% нитрата натрия по массе? Ответ округлите до ближайшего
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 15 г.
43/59
45. 11271
Сколько граммов
40%-го раствора гидроксида калия надо смешать с 200 г 10%-го раствора этого
вещества, чтобы получить 15%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 40.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 15%-го раствора нужно 5 частей 40%-го раствора и 25 частей 10%-го
раствора. Составив пропорцию, получаем:
Ответ: 40.
44/59
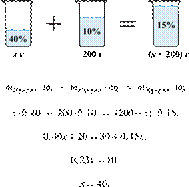
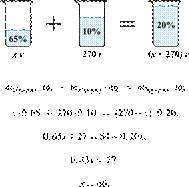
46. 11306
Сколько граммов
65%-го раствора азотной кислоты надо смешать с 270 г 10%-го раствора этого
вещества, чтобы получить 20%-й раствор? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При смешивании растворов суммарная
масса растворённого вещества не изменяется.
Получаем равенство:
Ответ: 60.
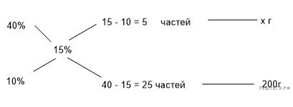
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 20%-го раствора нужно 10 частей 65%-го раствора и 45 частей
10%-го раствора. Составив пропорцию, получаем:
Ответ: 60.
45/59
47. 11341
При разбавлении
35%-й соляной кислоты получили 210 г 10%-й кислоты. Сколько граммов 35%-го
раствора было взято? Ответ выразите в виде целого числа Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
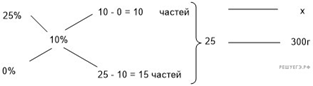
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 35%-й кислоты и 25 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 60.
46/59
48. 11376
При разбавлении
25%-го раствора аммиака получили 300 г 10%-го раствора. Сколько граммов 25%го
раствора было взято? Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 120.
Приведём другое решение:
Задачи такого типа могут быть решены
методом креста («конверт» Пирсона).
Значит, для
приготовления 10%-го раствора нужно 10 частей 25%-го раствора и 15 частей воды.
Составив пропорцию, получаем:
Ответ просят дать с точностью до
целых.
Ответ: 120.
47/59
49. 12382
200 г горячего
30%-го раствора соли охладили до комнатной температуры. Сколько граммов соли
выпадет в осадок, если насыщенный при комнатной температуре раствор содержит
20% соли по массе?
Осадок представляет собой безводную
соль. Ответ запишите с точностью до целых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 25.
48/59
50. 12417
Насыщенный раствор
содержит 30 % соли по массе. Сколько граммов соли нужно растворить в 350 г
20%-го раствора для получения насыщенного раствора? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 50.
49/59
51. 12616
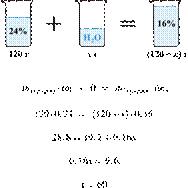
Имеется 120 г
24%-го раствора вещества. Из него надо получить 16%-й раствор. Сколько граммов
воды требуется добавить? Ответ округлите до ближайшего целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 60.
50/59
52. 12651
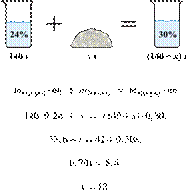
Имеется 140 г
24%-го раствора вещества. Из него надо получить 30%-й раствор. Сколько граммов
чистого вещества требуется добавить? Ответ округлите до ближайшего целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 12.
51/59
53. 12865
Сколько граммов
чистого вещества надо добавить к 100 г его 20%-го раствора, чтобы получить 36%й
раствор? Ответ представьте в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
вещества не изменяется.
Получаем равенство:
Ответ: 25.
52/59
54. 13033
30 граммов чистого
вещества добавили к 10%-му раствору этого вещества и получили 16%-й раствор.
Сколько граммов 10%-го раствора было взято? Ответ представьте в виде целого
числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 420.
53/59
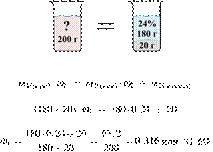
55. 13095
Горячий раствор
нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и
образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата калия
(в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 31,6%.
54/59
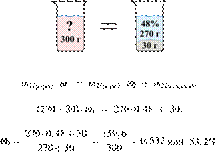
56. 13130
Горячий раствор
нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и
образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата
натрия (в процентах) в горячем растворе? Ответ округлите до десятых.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При охлаждении
раствора, сопровождающегося кристаллизацией, суммарная масса соли не
изменяется.
Получаем равенство:
Ответ просят дать с точностью до
десятых.
Ответ: 53,2%.
55/59
57. 13557
В 81 г воды
растворили 9 г сульфата натрия. Вычислите массовую долю вещества (в процентах) в
полученном растворе. (Запишите число с точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
Ответ просят дать с точностью до
целых.
Ответ: 10%.
56/59
58. 13630
К 250 г 12%-го
раствора гидроксида калия добавили твердый KOH и после перемешивания получили
20%-й раствор. Сколько граммов твердой щёлочи добавили? Ответ выразите в виде
целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса
гидроксида калия не изменяется.
Получаем равенство:
Ответ: 25.
57/59
59. 13665
К 300 г 15%-го
раствора хлорида калия добавили твёрдый и после
перемешивания получили 25%-й раствор. Сколько граммов твёрдой соли добавили?
Ответ выразите в виде целого числа.
Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При растворении суммарная масса соли
не изменяется.
Получаем равенство:
Ответ: 40.
58/59
60. 13704
Найдите массу воды, которую необходимо
добавить к 130 г 20%-го раствора соли, чтобы получить
13%-ый раствор. (Запишите число с
точностью до целых.) Решение.
Масса раствора,
масса растворённого вещества и массовая доля растворённого вещества связаны
соотношением:
При разбавлении раствора масса
растворённого вещества не изменяется.
Получаем равенство:
Ответ просят дать с точностью до
целых.
Ответ: 70 г.
59/59
- 09.03.2023
Пятый тренировочный вариант, составленный на основе демоверсии ЕГЭ 2023 года по химии от ФИПИ. Вариант включает все задания кодификатора 2023 года и учитывает все изменения, которые произошли в 2023 году (полный список изменений). Вариант содержит правильные ответы и подробные разборы для второй части теста — задания повышенной сложности. Ответы сохранены в конце варианта.
- Другие тренировочные варианты по химии
В варианте присутствуют задания на знание химических элементов и соединений, на составление и балансировку химических уравнений, на расчет массы вещества и концентрации растворов, а также на проведение простых химических экспериментов. Сам тренировочный вариант состоит из нескольких частей. В первой части представлены задания на знание химических элементов и соединений. Вторая часть содержит задания на балансировку химических уравнений и расчет массы вещества. Третья часть включает задания на расчет концентрации растворов и проведение простых химических экспериментов.
Задания из тренировочного варианта №5
Вещества для заданий с 1 по 3. 1) Не 2) Са 3) Cr 4) Cl 5) Se
Задание 1. Из указанных в ряду элементов выберите два элемента, атомы которых имеют сходную конфигурацию внешнего электронного слоя.
Задание 2. Из указанных в ряду химических элементов выберите три элемента, находящихся в одном периоде. Расположите выбранные элементы в порядке увеличения электроотрицательности.
Задание 3. Из указанных в ряду элементов выберите два элемента, в соединении с которыми водород способен проявлять отрицательную степень окисления.
Задание 4. Из предложенного перечня выберите два вещества, между молекулами которых образуются водородные связи.
- метилэтиловый эфир
- аланин
- триметиламин
- плавиковая кислота
- серная кислота
Задание 11. Из предложенного перечня выберите два вещества, являющиеся межклассовыми изомерами.
- нитроэтан
- пропанол-1
- глицин
- диметиловый эфир
- этиламин
Задание 13. Из предложенного перечня выберите два вещества, с каждым из которых может взаимодействовать метиламин.
- С6Н6
- О2
- СН4
- KOH
- СН3(СН2)2СООН
Задание 17. Из предложенного перечня выберите все наборы веществ, реакция между которыми протекает без изменения степени окисления.
- C2H6 и Cl2 (hν)
- фенол и NaOH
- NO2 и H2O
- Na2O2 и H2O (t°)
- K2CrO4 и H2SO4
Задание 18. Из предложенного перечня выберите все факторы, приводящие к уменьшению скорости реакции алюминиевой пластинки с 15%-ным раствором серной кислоты.
- добавление твердой щелочи
- добавление хлорида алюминия
- увеличение концентрации кислоты до 95%
- использование пластинки большей толщины
- замена серной кислоты на уксусную такой же концентрации
Задание 21. Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
- поваренная соль
- серная кислота
- нитрит натрия
- акриловая кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Смотреть в PDF:
Или прямо сейчас: cкачать в pdf файле.
- ЕГЭ по химии
Окислитель и восстановитель. Реакции окислительно-восстановительные — Задание 29 ЕГЭ 2022 по химии .
Практика и критерии к заданию №29.
→ задание №29 практика (55 задач с решениями)
→ критерии оценивания
Источник: vk.com/chem4you
Примеры заданий:
[1] Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция. В ходе этой реакции образуется окрашенный газ. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: фторид натрия, дихромат калия, хлороводород, серная кислота, иодид лития, гидроксид железа (II). Допустимо использование водных растворов.
[2] Из предложенного перечня выберите кислоту и вещество, между которыми протекает окислительно-восстановительная реакция с образованием газа. В ходе этой реакции в процессе восстановления участвует один электрон (в пересчете на один атом окислителя). Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: серная кислота, иодоводород, ацетат бария, нитрит калия, хлорид натрия, гидроксид железа (III). Допустимо использование водных растворов.
[3] Из предложенного перечня выберите два вещества, между которыми протекает окислительно-восстановительная реакция. В ходе этой реакции выделяется газ. Запишите уравнение реакции с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Перечень веществ: сернистый газ, хлорид меди (II), фосфор, серная кислота, ацетат калия, нитрат серебра. Допустимо использование водных растворов.
Смотрите также:
.011. Электронная конфигурация атома
.0217. Классификация химических реакций
.0318. Скорость химической реакции
.0419. Общие сведения об окислительно-восстановительных реакциях
.052. Закономерности изменения химических свойств элементов и их соединений по периодам и группам
.0620. Электролиз растворов и расплавов
.0721. Гидролиз солей. рН водных растворов солей, кислот, щелочей
.0822. Химическое равновесие
.0923. Расчёты параметров равновесной реакции
.1024. Качественные реакции и признаки реакций
.1125. Химия и жизнь
.123. Степень окисления и валентность химических элементов в их соединениях
.134. Типы химической связи. Тип кристаллической решётки вещества
.14Электролиз расплавов и растворов
Тренировочный вариант №2 КИМ №210927 ЕГЭ 2022 по химии 11 класс для подготовки на 100 баллов от 27 сентября 2021 года.
Вариант с ответами: скачать
Данный вариант составлен по новой демоверсии ФИПИ экзамена ЕГЭ 2022 года, к тренировочным заданиям прилагаются решения и правильные ответы.
Экзаменационная работа состоит из двух частей, включающих в себя 34 задания. Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом.
Решу ЕГЭ 2022 по химии 11 класс вариант 100 баллов №210927:
Сложные задания и ответы с варианта
1)Определите, атомы каких из указанных в ряду элементов в основном состоянии на внешнем уровне содержат одинаковое число неспаренных электронов. Запишите в поле ответа номера выбранных элементов.
Правильный ответ: 24
2)Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Правильный ответ: 253
3)Из указанных в ряду элементов выберите два элемента, у которых значение высшей степени окисления не совпадает с номером группы. Запишите в поле ответа номера выбранных элементов.
Правильный ответ: 14
4)Из предложенного перечня выберите два вещества, которые имеют атомную кристаллическую решётку. 1) угарный газ 2) сернистый газ 3) железная окалина 4) кремнезем 5) алмаз
Правильный ответ: 45
5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислой соли; Б) несолеобразующего оксида; В) гидроксида.
Правильный ответ: 893
6)Даны две пробирки с раствором гидроксида лития. В одну из них добавили несколько капель раствора вещества X, а в другую – раствор вещества Y при нагревании. В результате в пробирке с веществом Х видимых признаков реакции не наблюдалось, а в пробирке с веществом Y выделился газ с резким запахом. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
- 1) фосфат калия
- 2) сульфат меди(II)
- 3) хлорид аммония
- 4) карбонат кальция
- 5) нитрат цинка
Правильный ответ: 53
11)Из предложенного перечня выберите два вещества, которые являются изомерами.
- 1) нитроэтан
- 2) глицин
- 3) аланин
- 4) анилин
- 5) 4-нитрофенол
Правильный ответ: 12
12)Из предложенного перечня выберите все вещества, с которыми взаимодействует фенол.
- 1) этановая кислота
- 2) водород
- 3) оксид меди(II)
- 4) гидроксид натрия
- 5) бромная вода
Правильный ответ: 245
13)Из предложенного перечня выберите две пары веществ, взаимодействие которых между собой приводит к образованию осадка.
- 1) анилин и соляная кислота
- 2) анилин и хлорэтан
- 3) глюкоза и водород
- 4) глюкоза и гидроксид меди(II)
- 5) глюкоза и аммиачный раствор оксида серебра (при нагревании)
Правильный ответ: 45
18)Из предложенного перечня выберите все факторы, при которых скорость химической реакции SO2(г) + 2H2S(г) → 2H2O(ж) + 3S(тв.) уменьшается. 1) нагревание 2) добавление катализатора 3) уменьшение концентрации реагирующих веществ 4) уменьшение концентрации продуктов реакции 5) увеличение объема сосуда
Правильный ответ: 35
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). 1) ZnSO4 2) KNO3 3) NaOH 4) KHCO3
Правильный ответ: 3421
26)Смешали 240 г 12% раствора гидроксида натрия и раствор, в котором массовая доля гидроксида натрия в два раза меньше чем в первом растворе. Вычислите массу второго раствора (г), если образовался раствор с массовой долей гидроксида натрия 10,8%. (Запишите число с точностью до целых.)
Правильный ответ: 60
27)Разложение малахита протекает в соответствии с термохимическим уравнением реакции (CuOH)2CO3= 2CuO + H2O + CO2 — 47 кДж Определите массу (г) образовавшегося оксида меди(II), если в результате реакции поглотилось 22,75 кДж теплоты. (Запишите число с точностью до целых.)
Правильный ответ: 77
28)К избытку раствора серной кислоты добавили цинк массой 20,8 г. В результате получили газ, объемом (н.у.) 6,9 л. Определите практический выход газа (%). (Запишите число с точностью до десятых.)
Правильный ответ: 96,3
29)Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В результате этой реакции образуются две кислоты и два оксида. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции.
30)Из предложенного перечня веществ выберите слабый электролит и вещество, которое вступает с этим слабым электролитом в реакцию ионного обмена. В результате этой реакции образуется осадок. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
31)Оксид алюминия растворили в избытке раствора гидроксида натрия. К образовавшемуся раствору соли добавили избыток раствора соляной кислоты, а затем избыток раствора гидрокарбоната натрия. Выпавший осадок отделили, а к оставшемуся раствору добавили раствор перманганата калия в серной кислоте. В результате реакции выделился газ желто-зеленого цвета. Напишите уравнения четырёх описанных реакций.
33)Электролиз растворов сульфата меди(II) массой 320 г с массовой долей соли 7,3% и хлорида натрия массой 400 г с массовой долей соли 5,85% прекратили, когда масса каждого раствора уменьшилась на 11,68 г. После чего растворы слили. Вычислите массовую долю гидроксида натрия в образовавшемся растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
34)При сгорании органического вещества X массой 8,88 г выделяется 8,064 л (н.у.) углекислого газа и 6,48 г воды. Известно, что вещество X реагирует с натрием, но не вступает в реакцию с щелочами и не даёт реакцию серебряного зеркала. На основании данных условия задания:
- 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества c минимально возможной молярной массой;
- 2) составьте структурную формулу вещества Х, которая однозначно отражает порядок связи атомов в его молекуле;
- 3) напишите уравнение реакции взаимодействия данного вещества с натрием (используйте структурные формулы органических веществ).
Другие тренировочные варианты ЕГЭ 2022 по химии:
Пробный вариант №3 ЕГЭ 2022 по химии 11 класс с ответами и решением
Тренировочный вариант №1 в форме ЕГЭ 2022 по химии с ответами