Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления –2. Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Классификация оксидов, которую мы ещё раз с вами повторим:
- основные: металл в степени окисления +1 и +2;
- амфотерные: металл в степени окисления +3 и +4. Исключения: ZnO, BeO, SnO, PbO;
- кислотные: все неметаллы и металлы в степенях окисления +5, +6 и +7;
- несолеобразующие: NO, N2O, CO, SiO.
Физические свойства оксидов.
- По агрегатному состоянию оксиды делятся на три группы: твердые (K2O, Al2O3, P2O5), жидкие (SO3, Mn2O7), и газообразные (CO2, NO2, SO2).
- По растворимости в воде оксиды делятся на растворимые (SO2, CO2, K2O) и нерастворимые (CuO, FeO, SiO2, Al2O3). Все кислотные оксиды, кроме SiO2, растворимы в воде. Среди основных оксидо растворимыми являются только оксиды щелочных металлов и щелочноземельных металлов. Амфотерные оксиды не растворяются в воде.
Химические свойства основных оксидов
1. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей:
Оксид + H2O = Щелочь;
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
2. Общим свойством всех основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды:
Оксид + кислота = соль + H2O
CaO + H2SO4 = CaSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
3. Основные оксиды взаимодействуют с кислотными оксидами с образованием солей:
Основные оксид + кислотный оксид = Соль
3СaO + P2O5 = Ca3(PO4)2
BaO + CO2 = BaCO3
Химические свойства кислотных оксидов
1. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Кислотный оксид + H2O = кислота
P2O5 + 3H2O = 2H3PO4
N2O5 + H2O = 2HNO3
2. Общим свойством всех кислотных оксидов является их способность взаимодействовать с овнованиями с образованием соли и воды:
кислотный оксид + основание = соль + H2O
P2O5 + 6NaOH = 2Na3PO4 + 6H2O
SO2 + Ca(OH)2 = CaSO3 + H2O
3. Кислотные оксиды взаимодействую с основными оксидами с образованием солей (при нагревании)
Ксилотный оксид + основные оксид = соль;
3CaO + P2O5 = Ca3(PO4)2
CrO3 + CaO = CaCrO4
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды — проявляют свойства основных оксидов.
Амфотерный оксид + кислота = соль + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
2. Амфотерные оксиды взаимодействуют со щелочами с образованием солей и воды — проявляют свойства ксилотных оксидов.
Амфотерный оксид + щелочь = соль + H2O
ZnO + KOH = K2ZnO2 + H2O
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.
Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.
Амфотерный оксид + основный оксид = соль
ZnO + Na2O = Na2ZnO2
Получение оксидов
1. Взаимодействие простых веществ с кислородом:
Металл или неметалл + O2 = Оксид
2. Разложение некоторых оксокислот:
Оксокислота = кислотный оксид + H2O
3. Разложение нерастворимых основний:
Нерастворимое основание = основный оксид + H2O;
4. Разложение некоторых солей:
Соль = основный оксид + кислотный оксид
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например, алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
2Na + O2 → Na2O2
Калий, цезий, рубидий образуют преимущественно надпероксиды состава MeO2:
K + O2 → KO2
Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
4Fe + 3O2 → 2Fe2O3
4Cr + 3O2 → 2Cr2O3
Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
4P + 5O2(изб.) → 2P2O5
4P + 3O2(нед.) → 2P2O3
Но есть некоторые исключения.
Например, сера сгорает только до оксида серы (IV):
S + O2 → SO2
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
2H2S + 3O2(изб.) → 2H2O + 2SO2
2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
4NH3 + 3O2 →2N2 + 6H2O
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
H2CO3 → H2O + CO2
H2SO3 → H2O + SO2
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H2SiO3 → H2O + SiO2
2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Li2CO3 → CO2 + Li2O
CaCO3 → CaO + CO2
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Химические свойства основных оксидов.
Химические свойства кислотных оксидов.
Химические свойства амфотерных оксидов.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
ХИМИЧЕСКИЕ СВОЙСТВА НЕСОЛЕОБРАЗУЮЩИХ ОКСИДОВ
Несолеобразующие оксиды не реагируют с растворами щелочей и с кислотами.
1. ОКИСЛИТЕЛЬНЫЕ СВОЙСТВА:
Несолеобразующие оксиды могут реагировать с водородом.
Например, смеси оксидов азота (I) и (II) с водородом взрывают.
N2O + H2 = N2 + H2O 2NO + 2H2 = N2 + 2H2O
Смесь угарного газа с водородом называется синтез-газом, ее применяют для получения ряда органических соединений, например, метанола.
2. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА:
Реагируют с кислородом, например, угарный газ CO горит при поджигании голубым пламенем.
2CO + O2 = 2CO2
Бесцветный оксид азота (II) окисляется на воздухе при обычных условиях до оксида азота (IV) — газообразного вещества, имеющего бурую окраску.
2NO + O2 = 2NO2
При взаимодействии угарного газа с хлором при нагревании над активированным углем образуется фосген, который применяют для производства пластмасс.
2CO + Cl2 = 2COCl2
Оксид азота (I) — термодинамически нестабильное соединение и при нагревании разлагается.
2N2O = 2N2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. ОСНОВНЫЙ ОКСИД + КИСЛОТА + СОЛЬ + ВОДА
Кислоты должны существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная)
Li2O + 2HCl= 2LiCl+ H2O,
NiO + H2SO4 = NiSO4 + H2O
2. ОСНОВНЫЙ ОКСИД (IА группа, CaO, SrO, BaO) + ВОДА = ЩЕЛОЧЬ
Оксид реагирует с водой только если в результате образуется растворимый гидроксид (щелочь).
Li2O + H2O = 2LiOH
BaO + H2O = Ba(OH)2
3. ОСНОВНЫЙ ОКСИД + КИСЛОТНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива.
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
CuO + N2O5 = Cu(NO3) 2
СаО + SO2 = CaSO3
4. РЕАКЦИИ ОСНОВНЫХ ОКСИДОВ С ВОССТАНОВИТЕЛЯМИ
(СО, С, водород, алюминий, магний).
Многие оснóвные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем
FeO + H2 = Fe + H2O (при нагревании)
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
5. ОКИСЛЕНИЕ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ
Осуществима, если металл может иметь несколько оксидов с разными степенями окисления.
4FeO + O2 = 2Fe2O3
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
К кислотным оксидам относятся оксиды неметаллов и некоторые оксиды металлов групп Б, если металлы в этих оксидах находятся в высших степенях окисления (+5, +6, +7), например, CrO3, Mn2O7.
По агрегатному состоянию:
газы: СО2, N2O3, SO2, SeO2),
жидкости : Mn2O7
твердые вещества : B2O3, SiO2, N2O5, P4O6, P4O10, I2O5, CrO3).
1. КИСЛОТНЫЙ ОКСИД + ВОДА = КИСЛОТА
Не реагирует с водой только SiO2.
N2O3 + H2O = 2HNO2
SO2 + H2O = H2SO3
N2O5 + H2O = 2HNO3
SO3 + H2O = H2SO4
2.КИСЛОТНЫЙ ОКСИД + ОСНОВНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
CO2 + CaO = CaCO3
N2O5 + ZnO = Zn(NO3)2
P2O5 + 6FeO = 2Fe3(PO4)2 (при нагревании)
P4O10 + 6FeO = 2Fe3(PO4)2 (при нагревании)
3.КИСЛОТНЫЙ ОКСИД + ОСНОВАНИЕ = СОЛЬ + ВОДА
Реакция возможна только со щелочами, но оксиды сильных кислот
SO3, CrO3, N2O5, Cl2O7 реагируют и с нерастворимыми основаниями.
CO2 + Ca(OH) 2 = CaCO3 + H2O
SiO2 + 2KOH = K2SiO3 + H2O (при нагревании),
SO3 + 2NaOH = Na2SO4 + H2O,
N2O5 + 2KOH = 2KNO3 + H2O.
4.КИСЛОТНЫЙ ОКСИД + СОЛЬ БОЛЕЕ ЛЕТУЧЕЙ КИСЛОТЫ = СОЛЬ + ЛЕТУЧИЙ ОКСИД
Твёрдые, нелетучие оксиды (SiO2,P2O5) вытесняют из солей летучие.
SiO2 + K2CO3 = K2SiO3 + CO2 (при нагревании)
5.ОКИСЛЕНИЕ ОКСИДОВ ДО БОЛЕЕ ВЫСОКОЙ СТЕПЕНИ ОКИСЛЕНИЯ:
Для элементов, которые образуют несколько оксидов с разной степенью окисления.
а) кислородом:
2СО + О2 = 2СО2
2SO2 + O2 ⇆ 2SO3
б) озоном:
NO + O3 = NO2 + O2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
К амфотерным оксидам относят ZnO, Al2O3, BeO, Cr2O3, PbO и некоторые другие оксиды.
Амфотерные оксиды обладают свойствами и оснóвных, и кислотных оксидов.
ОСНОВНЫЕ СВОЙСТВА
1.ОКСИД + КИСЛОТА = СОЛЬ + ВОДА
Только с сильными кислотами
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + HNO3 = Al(NO3)3 +H2O
2.КИСЛОТНЫЙ ОКСИД + АМФОТЕРНЫЙ ОКСИД = СОЛЬ
Соль должна быть устойчива
ZnO+ SiO2 = ZnSiO3
КИСЛОТНЫЕ СВОЙСТВА
1. ПРИ СПЛАВЛЕНИИ С ОКСИДАМИ ОБРАЗУЕТ СРЕДНИЕ СОЛИ.
ZnO2(2-) — цинкат
BeO2(2-) — бериллат
AlO2(-) — алюминат
CrO2(-) — хромат
ZnO + Na₂O = Na₂ZnO2.
2.АМФОТЕРНЫЙ ОКСИД + РАСПЛАВ ЩЕЛОЧИ + СОЛЬ
Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов.
Al2O3 + 2KOH = 2KAlO2 + H2O (при нагревании)
ZnO + 2KOH =K2ZnO2 + H2O (при нагревании)
3.АМФОТЕРНЫЙ ОКСИД + РАСТВОР ЩЕЛОЧИ = РАСТВОР ГИДРОКСОКОМПЛЕКСА
[Zn(OH)4 ](2-) — тетрагидроксоцинкат
[Be(OH)4](2-) — тетрагидроксобериллат
[Al(OH)4](-) — тетрагидроксоалюминат
[Cr(OH)4](-) — тетрагидроксохромат
Al2O3 + 2KOH +3H2O = 2K[Al(OH)4]
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO2
4.АМФОТЕРНЫЙ ОКСИД + КАРБОНАТЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ = СОЛЬ + ГАЗ
При сплавлении могут взаимодействовать с карбонатами щелочных металлов, как со щелочами.
Al2O3 + Na2CO3 = NaAlO2 (или Na3AlO3) + CO2(при нагревании)
ZnO + Na2CO3 = Na2ZnO2+ CO2(при нагревании)
5.ВЗАИМОДЕЙСТВИЕ С СИЛЬНЫМИ ВОССТАНОВИТЕЛЯМИ
ZnO + C = Zn + CO;
ZnO + CO = Zn + CO2;
ZnO + H2 = Zn + H2O
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2
ПОЛУЧЕНИЕ МЕТАЛЛОВ
1 . МЕТАЛЛЫ И НЕМЕТАЛЛЫ С КИСЛОРОДОМ →
Реагируют все металлы, кроме золота, платины. Натрий, калий, рубидий, цезий сразу образуют пероксиды и надпероксиды. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив.
4Cr + 3О2 = 2Cr2О3
C+ O₂ (нед) = CO
2. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ:
Неактивные металлы реагируют с водой только в раскаленном состоянии , образуя оксиды (железо – железную окалину)
Zn + Н2O = ZnO + H2 ↑ 3Fe + 4HOH = Fe3O4 + 4H2↑
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ОКСИДАМИ (оксидами неметаллов и менее активных металлов)
Металлы (Al, Mg,Са ), восстанавливают при высокой температуре неметаллы или менее активные металлы из их оксидов → неметалл или малоактивный металл и оксид (кальцийтермия, магнийтермия, алюминотермия)
2Al + Cr2O3 = 2Cr + Al2O3
ЗСа + Cr₂O₃ = ЗСаО + 2Cr (800 °C)
Металлы железо и хром реагируют со оксидами, уменьшая степень окисления
Cr + Cr2⁺³O3 = 3Cr⁺²O
4. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ПЕРОКСИДАМИ
Щелочные металлы при взаимодействии с пероксидами переводят их в оксиды
2Na + Na2O2 = 2Na2O
3K+ KO2 = 2K2O
5.ВЗАИМОДЕЙСТВИЕ УГЛЕРОДА С ОКСИДАМИ
2ZnO + C = 2Zn + CO
4С + Fe₃O₄ = 3Fe + 4CO
6.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С НИЗШИМИ С ОКСИДАМИ
окисляет низшие оксиды до высших:
2Fe⁺²O + O2 = Fe2⁺³O3;
2C⁺²O + O2 = 2C⁺⁴O2
7.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С КИСЛОТАМИ
Безводные бескислородные кислоты (бинарные соединения) сгорают в атмосфере кислорода
2H2S + 3O2 = 2SO2 + 2H2O
8.ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С СОЛЯМИ И БИНАРНЫМИ СОЕДИНЕНИЯМИ
Горение
4FeS2 +11O2 = 2Fe2O3 + 8SO2
CH4 + 2O2 = CO2 + 2H2O
Каталитическое окисление
NH3 + O2 = NO + H2O
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ МЕТАЛЛОВ
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ А — ОСНОВНЫЕ ОКСИДЫ:
MgO (жженная магнезия), CaO (негашёная известь, жжёная известь, кипелка. Порошок белого цвета), SrO. ВaО
СаО + 3С = СаС2 + СО↑
III ГРУППА А ОКСИД АЛЮМИНИЯ А12О3 —-АМФОТЕРНЫЙ с преобладание основных свойств
Al2O3 — очень твердый белого цвета(корунд), тугоплавкий — 2050⁰С
Реагирует с солями
А12O3 + Na2CO₃ (тв) = 2NaA1O2 + СO2↑
I ГРУППА Б ОКСИДЫ МЕДИ.
ОКСИД МЕДИ (I) твердое вещество красного цвета, нерастворимые в воде, имеют основный характер.
Взаимодействует с разбавленной серной кислотой с образование меди, сульфата меди (II), воды.
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Взаимодействует с водным растворoм аммиака.
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2OH]
ОКСИД МЕДИ (II) твердое вещество черного цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
CuO + NaOH + H2O = Na2[Cu(OН)4] (тетрагидроксокупрат)
Восстанавливается при нагревании водородом, углеродом, угарным газом, аммиаком и более активными металлами
→ медь + соответствующий оксид или неметалл.
ЗСuО + 2NH3 = ЗСu + N2↑ + 3H2О
II ГРУППА Б ОКСИД ЦИНКА (II)
Твердое вещество белого цвета, нерастворимые в воде, имеют амфотерный характер.
Взаимодействует с растворами щелочей
ZnO + NaOH + H2O = Na2[Zn(OН)4] (тетрагидроксоцинкат)
VI ГРУППА Б ОКСИДЫ ХРОМА.
ОКСИД ХРОМА (II) имеют основный характер. Красные кристаллы или черный пирофорный порошок.
ОКСИД ХРОМА (III) Cr₂O₃ АМФОТЕРНЫЙ
зелёный, нерастворимый в воде порошок.
Получают при прокаливании гидроксида хрома (III), дихроматов калия и аммония или окислении оксида (II):
2Cr(OH)₃= Cr₂O₃ + 3H₂O
4K₂Cr₂O₇ = 2Cr₂O₃ + 4K₂CrO₄(хромат калия) + 3O₂↑
(NH ₄)₂Cr₂O₇ = Cr₂O₃ + N₂↑ + 4H₂O
1. При сплавлении Cr₂O₃ с оксидами, щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + FeO = Fe(CrO2)2
Cr₂O₃ + 2NaOH = 2NaCrO₂ (хромит натрия) + H₂O
Cr₂O₃ + Na₂CO₃ = 2NaCrO₂ + CO₂↑
Cr₂O₃ + 6KHSO₄ = Cr₂(SO₄)₃ + 3K₂SO₄ + 3H₂O
2. При сплавлении со смесью щёлочи и окислителя проявляют свойства восстановителя, получают соединения хрома в
степени окисления (+6):
2Cr₂O₃ + 4KOH + KClO₃ = 2K₂Cr₂O₇(дихромат калия) + KCl + 2H₂O
Сг2O3 + KClO₃ + 2К2СO3 = 2К₂CrO4 + КС1 + 2CO2↑
Cr2O3 + 3NaNO3 + 2Na2CO3 = 2Na2CrO4 + 3NaNO2 + 2CO2↑
Cr2O3 + 3KNO3 + 4KOH = 2Na2CrO4 + 3KNO2 + 2H₂O
5Cr2O3 + 6NaBrO3 + 3H2SO4 + 2H2O = 5H2Cr2O7 + 3Br2 + 3Na2SO4
ОКСИД ХРОМА (VI) CrO₃ — кислотный оксид,
кристаллическое вещество тёмно-красного цвета, сильный окислитель.
Взаимодействует с водой → хромовая или двухромовая кислота
CrО3 + Н2О = Н2СrО4
2. основными оксидами и основаниями
CrО3 + CaO = СаСrО4
CrО3 + 2NaOH = Na2СrО4 + H2О
3. Сильный окислитель: окисляет неорганические и органические вещества
4CrО3 + 3S = 3SО2↑ + 2Cr2О3
4CrО3 + C2H5OH + 6H2SО4 = 2Cr2(SО4)3 + 2CО2↑ + 9H2О
4. Разлагается при нагревании
4CrО3 = 2Cr2О3 + 3О2↑
Получают из хромата (или дихромата) калия и H₂SO₄(конц.).
K₂CrO₄ + H₂SO₄ →CrO₃ + K₂SO₄ + H₂O
K₂Cr₂O₇ + H₂SO₄ →2CrO₃ + K₂SO₄ + H₂O
VII ГРУППА Б ОКСИДЫ МАРГАНЦА
ОКСИД МАРГАНЦА(II) MnO ОСНОВНЫЙ
Твердое вещество зеленого цвета, не растворимое в воде
ОКСИД МАРГАНЦА (III) Mn2O3 ОСНОВНЫЙ
Твердое вещество бурого цвета цвета, не растворимое в воде
Обладает окислительными свойствами
Mn2O3 + H2 = 2MnO + H2O
Обладает восстановительными свойствами, реагируя с разбавленной серной кислотой:
2Mn2O3 + 4H2SO4 = 2MnO2 + Mn2(SO4)3 + SO2 + 4H2O
ОКСИД МАРГАНЦА (VI) MnO3
В свободном состоянии не выделен
ОКСИД МАРГАНЦА (VII) Mn₂O₇ КИСЛОТНЫЙ
тёмно-зелёная жидкость, растворяется в воде, неустойчив.
Получают действием концентрированной серной кислоты на кристаллический KMnO₄ (марганцевая кислота HMnO₄ нестабильна):
2KMnO₄ + H₂SO₄ → Mn₂O₇ + + K₂SO₄ + H₂O
1. При растворении в щелочах образует перманганаты:
Mn₂O₇ + 2KOH → 2KMnO₄ + H₂O
2. При ударе и слабом нагревании разлагается со взрывом до MnO2:
2Mn₂O₇ → 2MnO2 + 3HO₂↑
VIII ГРУППА Б ОКСИДЫ ЖЕЛЕЗА
ОКСИД ЖЕЛЕЗА (II) FeO ОСНОВНЫЙ
порошок черного цвета, нерастворимый в воде.
обладают восстановительными свойствами, соединения железа со степенью окисления железа +2 малоустойчивы они легко превращаются в соединения железа (III) под действием окислителей:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5H2O.
ОКСИД ЖЕЛЕЗА (III) Fe₂O₃ АМФОТЕРНЫЙ
Твердое вещество бурого цвета, нерастворимое в воде
Оксид образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂↑
или при прокаливании солей железа:
2FeSO₄ →Fe₂O₃ + SO₂↑ + SO₃↑
ИНДИВИДУАЛЬНЫЕ СВОЙСТВА ОКСИДОВ НЕМЕТАЛЛОВ
IV ГРУППА А ОКСИДЫ УГЛЕРОДА.
Угарный газ – бесцветный, без запаха, плохо растворим в воде, токсичен, ядовит.
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь, за счѐт дополнительной донорно-акцепторной связи.
1) реагирует с водородом, в зависимости от условий образуются
разные продукты:
СО + Н2 = СН4↑ (метан) + Н2О СО + Н2 = СН3ОН (метанол)
2) под давлением реагирует со щелочью, образуя формиат – соль муравьиной кислоты:
CO + NaOH = HCOONa (формиат натрия)
CO2 -КИСЛОТНЫЙ О=С=О
Углекислый газ – без цвета, без запаха, при сжижении образует «сухой лед»
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
С аммиаком образует мочевину :
CO2 + 2NH3 → NH2-CO-NH2 + H2O
ОКСИД КРЕМНИЯ (IV) SIO2 – КИСЛОТНЫЙ оксид.
В природе – речной песок, кварц, кремнезем, без цвета, без запаха, единственный из кислотных нерастворимый в воде.
Имеет атомную кристаллическую решетку.
1) Из кислот реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF (р-р)= H2[SiF6] + 2H2O
2) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
3) Взаимодействие с неметаллами.
с водородом: SiO2 + 2Н2 = Si + 2Н2O,
с углеродом: SiO2 + 3С = SiС + 2СO.
N₂O ОКСИД АЗОТА (I) ЗАКИСЬ АЗОТА, «веселящий газ“ НЕСОЛЕОБРАЗУЮЩИЙ
Бесцветный газ, со слабым сладковатым запахом, хорошо растворим в воде.
1. Разлагается при 700°C с выделением кислорода:
2N2O = 2N2+ O2
2. Окислитель, поддерживает горение, как кислород.
С водородом: N2O + H2 = N2 + Н2O,
с углеродом: N2O + C = N2 + CO
с фосфором: 5N2O + 2Р = 5N2 + Р2O5
NO ОКСИД АЗОТА (II) ОКИСЬ АЗОТА НЕСОЛЕОБРАЗУЮЩИЙ
бесцветный газ, без запаха, плохо растворим в воде.
Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2 2NO + Cl2 = 2NOCl (хлористый нитрозил)
Может быть окислителем, переходя в простое вещество азот: в нѐм могут гореть водород, углерод и т.п.
2NO + 2H2 =N2 + 2H2O
2NO + 2SO2 =2SO3 + N2
N2O3 ОКСИД АЗОТА (III), АЗОТИСТЫЙ АНГИДРИД
темно-синяя жидкость (при низких температурах). КИСЛОТНЫЙ
Получение:NO2 + NO ⇄ N2O3 (при охлаждении)
NO2 ОКСИД АЗОТА (IV), ДИОКСИД АЗОТА, «ЛИСИЙ ХВОСТ» КИСЛОТНЫЙ
бурый газ, специфический запах, токсичен, взаимодействует с водой — (даѐт 2 кислоты)
1. Кислотный оксид, образует две кислоты сразу с водой:
2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
2) со щелочами:
2NO2 +2NaOH =NaNO2+NaNO3 +H2O
3. Окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 2С = 2СO2 + N2
5NO2 + 2Р = Р2O5 + 5NO
3. Димеризация:
2NO2(бурый газ)⇄ N2O4(бесцветная жидкость) – димер.
N2O5 ОКСИД АЗОТА (V) АЗОТНЫЙ АНГИДРИД
кристаллическое вещество, легко плавится (40°С) КИСЛОТНЫЙ
1. Сильный окислитель:
2N2O5 + S = SO2 +4NO2
2. Легко разлагается (при нагревании – со взрывом):
2N2O5 = 4NO2 + O2
ОКСИДЫ ФОСФОРА
P2O3 — ФОСФОРИСТЫЙ АНГИДРИД (оксид фосфора (III). КИСЛОТНЫЙ
Белые кристаллы, в парах состоит из молекул димера P4O6.
1. Взаимодействие с водой:
P2O3 + 3H2O = 2H3PO3
2. Взаимодействие с основаниями
P2O3+ 4NaOH = 2Na2HPO3+ H2O
2. Сильный восстановитель:
O2 + P2O3 = P2O5
P2O5 (ОКСИД ФОСФОРА (V) КИСЛОТНЫЙ ФОСФОРНЫЙ АНГИДРИД).
Белые кристаллы. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Реакция с водой – в зависимости от количества воды – образуются разные кислоты
P2O5 + H2O = 2HPO3 (метафосфорная кислота)
P2O5 + 2H2O =H4P2O7 (пирофосфорная кислота)
P2O5 +3H2O = 2H3PO4 (ортофосфорная кислота)
2) Сильное водоотнимающее средство, можно использовать для получения ангидридов сильных кислот:
P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
VI ГРУППА А ОКСИДЫ СЕРЫ
SO2 (СЕРНИСТЫЙ АНГИДРИД; СЕРНИСТЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветный газ с резким запахом, хорошо растворимый в воде. Обладает восстановительными и окислительными свойствами
1) Реакции окисления S⁺⁴ – 2ē = S⁺⁶
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 +2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
2) Реакции восстановления S ⁺⁴ + 4ē = S⁰
SO2 + С = S + СO2
SO2 + 2H2S = 3S + 2H2O
SO3 (СЕРНЫЙ АНГИДРИД; СЕРНЫЙ ГАЗ) КИСЛОТНЫЙ
Бесцветная жидкость с резким запахом, хорошо растворима в воде. Обладает сильными окислительными свойствами
Взаимодействует с концентрированной серной кислотой, образуя олеум.
SO3 + H2SO4 = H2S2O7
VII ГРУППА А ОКСИДЫ ГАЛОГЕНОВ
Большинство оксидов галогенов неустойчивы и получаются косвенным путем, так как галогены с кислородом не взаимодействуют.
ОКСИД ХЛОРА(I) Cl2O — ядовитый газообразный газ желтого цвета, с резким запахом, хорошо растворим в воде.
Соединение крайне неустойчиво, при повышенной температуре разлагается со взрывом.
Cl2O хорошо растворим в воде, его водный раствор проявляет свойства слабой кислоты:
H2O + Cl2O = 2HClO (хлорноватистая кислота).
ОКСИД БРОМА (I) Br2O напоминает по свойствам и методу синтеза Cl2O.
ДИОКСИД ХЛОРА ClO2 . КИСЛОТНЫЙ
Газ красно-желтого цвета. Используется как отбеливающее вещество.
Взрывается газ от внезапного механического воздействия, введения в систему восстановителя (резиновая пробка).
В щелочной среде ClO2 диспропорционирует
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
ДИОКСИД БРОМА BrO2. КИСЛОТНЫЙ
BrO2- неустойчивый оксид, при повышении температуры разлагается.
BrO2 →2Br2O + 2Br2↑ + 7O2↑
ОКСИД ХЛОРА (VI) Cl2O6 КИСЛОТНЫЙ
красная маслообразная жидкость, взрывоопасная, легко разлагается на ClO2 и O2.
Является смешанным ангидридом кислот HClO3 и HClO4.
Cl2O6 + H2O = HClO3 + HClO4.
ОКСИД ИОДА (V) I2O5 КИСЛОТНЫЙ
белое твердое вещество, единственный термодинамически устойчивый из оксидов галогенов.
I2O5 используется как окислитель в количественном анализе для определения СО:
5СО + I2O5 → I2 + 5CO2.
ОКСИД ХЛОРА (VII) Cl2O7 КИСЛОТНЫЙ
маслянистая бесцветная жидкость, легко взрывается.
Cl2O7 — ангидрид хлорной кислоты HClO4.
Получают дегидратацией концентрированной хлорной кислоты с помощью P2O5 с последующей осторожной перегонкой в вакууме:
6HClO4 + P2O5 → 3Cl2O7 + 2H3PO4.
8(Б), 31(П), 37(В) Перекиси и другие бинарные соединения (теоретический курс)
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства основных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства амфотерных оксидов
8(Б) Тесты ЕГЭ ФИПИ 2015 Свойства кислотных оксидов
Характерные химические свойства: оксидов: основных, амфотерных, кислотных
1. Оксид азота (V) взаимодействует с каждым из двух веществ:
1) вода и серная кислота
2) кислород и оксид магния
3) вода и оксид кремния
4) оксид натрия и гидроксид натрия 5) вода и оксид меди
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и водой 2) оксидом кальция и оксидом серы (IV) 3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV) 5) оксидом кальция и гидроксидом натрия
3. Оксид серы (IV) взаимодействует с 1) Са(ОН)2, 2) SiO2 3) K2SO4 4) СаСОз 5) O2
5. Способны взаимодействовать между собой
1) SiO2 и Н2О 2) СО2 и H2SO4 3) SO2 и Са(ОН)2 4) Na2O и Са(ОН)2 5) А12О3 и СаО
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) FeO 5) N2O
7. Реагирует с соляной кислотой, но не с водой, оксид 1) CuO 2) N2O3 3) Na2О 4) Fе2O3 5) SiО2
8. Между собой взаимодействуют 1) NO и А12О3 2) СО и ВаО 3) Р2О5 и SO2 4) ВаО и SO2 5) А12О3 и K2О
10. Между собой НЕ взаимодействуют 1) СuО и FeO 2) СО2 и ВаО 3) Р2О5 и NO 4) Сг2О3 и SO3 5) SO2 и Са(ОН)2
11. Реакция возможна между1) Н2О и А12О3 2) СО2 и СаО 3) Р2О3 и SO2 4) Н2О и ВаО 5) СаО и FeO
12. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО2 2) AI2O3 3) СО2 4) MgO 5) ZnO
13. Реакция возможна между 1) ВаО и N2O 2) А12О3 и Н2О 3) Р2О5 и НС1 4) MgO и SO3 5) CuO и H2
14. Оксид натрия не взаимодействует с 1) FeO 2) СО2 3) Ca(OH)2 4) А12О3 5) Н2О
15. Оксид углерода (IV) не реагирует с
1) оксидом кальция 2) кислородом
3) сульфатом калия 4) гидроксидом натрия 5) водой
16. Оксид цинка не реагирует с 1) P2O5 2) CO 3) CrO 4) NaOH 5) Н2О
17. Какие из двух оксидов не могут взаимодействовать между собой?
1) СаО и СгО 2) СаО и NO2 3) SO2 и СО2 4) SiO2 и К2O 5) BeO и Р2О5
18. Реакция НЕ возможна между: 1) Н2О и ВаО 2) СО2 и СаО 3) Р2O3 и SO2 4) Н2О и А12О3 5) СО и О2
19. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
20. Из предложенного перечня выберите те которые реагируют с оксидом фосфора (V)
1) гидроксид натрия 2) вода 3) углекислый газ 4) кислород 5) оксид серы (VI)
21. Из предложенного перечня выберите два вещества с которыми реагируют и оксид фосфора (V) и оксид натрия : 1) гидроксид бария 2) вода 3) углекислый газ 4) кислород 5) азотная кислота
21.Из предложенного перечня выберите те с которыми реагирует оксид углерода (II)
1) оксид железа (II) 2) оксид серы (IV) 3) соляная кислота
4) гидроксид железа (III) 5) оксид меди (I)
22. Оксид кальция взаимодействует с каждым из двух веществ:
1) вода и соляная кислота 2) кислород и оксид магния 3) оксид кальция и гидроксид натрия 4) вода и медь 5) оксид берилия и гидроксид алюминия
23. Из предложенного перечня выберите те вещества с которыми реагирует оксид азота (V)
1) вода 2) оксид серы (VI) 3) фосфорная кислота 4) гидроксид лития 5) кислород
24. Оксид серы (VI) взаимодействует с каждым из трех веществ:
1) вода и соляная кислота и карбонат натрия 2) кислород и оксид магния и гидроксид алюминия
3) оксид кальция и гидроксид натрия и вода 4) вода и медь и нитрат цинка 5) оксид алюминия, вода , гидроксид кальция
25. Оксид хрома (III) взаимодействует с 1) AI2O3 2) NaOH 3) Н20 4) АlCl3 5)СО
Задания повышенного уровня сложности
26.Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
A) ZnO + NaOH сплавление 1) Na2ZnО2
Б) ZnO + NaOH + Н20 2) Na2ZnО2+ Н2O
В) ZnO + Na2CO3 сплавление 3) Na2ZnО2 + СO2
Г) ZnO + HC1 4) Na2[Zn(OH)4l
5) ZnCl2+ Н2O
27. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ
А) СО2 + Н20 1) СаСО3
Б) СО2 + СаО 2) СаС03 + Н20
В) СО2 из6ыток) + Са(ОН)2 3) Са(НСО3)2
Г) СО2+Са(ОН)2 4) Са(НС03)2+ Н20
5) СО + Н2
6) Н2СО3
28. Установите соответствие между названиями оксидов и перечнем веществ, с которыми они могут взаимодействовать.
НАЗВАНИЕ ОКСИДА ВЕШЕСТВА
А) оксид кремния (IV) 1) Al, HNO3, СО2
Б) оксид aзотa (IV) 2) FeO, СO2, Н2O
В) оксид бария 3) С, КОН, СаСО3
Г) оксид железа(III) 4) NaOH, Н2О, СаО
5) NO2, SO3. Н3РO4
6) Н2O, HNO3, Са(ОН)2
29. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид бериллия 1) СO2,НС1,Н2O
Б) оксид калия 2) NaOH,H2,HCl
В) оксид серы (IV) 3) NaOH,O2,H2O
Г) оксид железа (II) 4) HCl,NaOH,H2O
5) H3N,Ca(OH)2,O2
6) HCI, H2, O2
30. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид цинка 1) Н2O, HNO3, Са(ОН)2
Б) оксид лития 2) O2, HCl , HNO3
В) оксид хрома (VI) 3) H2O NaOH K2O
Г) оксид железа (II) 4) K2CO3 HCL NaOH
5) P2O5 H2O H2SO4
6) K2SO4 КОН, NO2,
31. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид натрия 1) Н2O, СаO, KOH
Б) оксид углерода (II) 2) Fe3O4, Н2O, Si
В) оксид хрома (III) 3) Н2, Fe3O4 , O2
Г) оксид фосфора (V) 4) Н2O, N2O5, H3PO4
5) HСl, NaOH, Al
32. Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать.
НАЗВАНИЕ ОКСИДА ФОРМУЛЫ ВЕЩЕСТВ
А) оксид азота (IV) 1) КОН, Mg, Na2CO3
Б) оксид натрия 2) КОН,С,Н2O
В) оксид кремния (IV) 3) N2 , NaOH, N2O5
Г) оксид хрома(II) 4) CO2, H2S, H2O
5) HNO3, CO, O2
6) HCI, Ca(OH)2, O2
33. Установите соответствие между реагирующими веществами и продуктами реакции.
|
34. Установите соответствие между реагирующими веществами и продуктами реакции.
|
Часть С
- Сульфид цинка подвергли обжигу , выделившийся газ пропустили через раствор гидроксида кальция до выпадения осадка, Образовавшиеся твердое вещество растворили в в серной кислоте. Оксид цинка образовавшийся в первой реакции сплавили с твердым карбонатом кальция. Напишите уравнения четырех описаных реакций.
- Оксид меди сплавили с углем, полученный газообразный продукт сожгли в избытке кислорода , а затем пропустили через раствор гидроксида кальция до образования осадка . осадок отделили и сплавили с оксидом кремния . напишите уравнения четырех описанных реакций.
- Карбонат цинка прокалили , газообразный продукт пропустили над раскалённым углем. А твердое вещество разделили на две части одну сплавили с твердым гидроксидом натрия. А вторую растворили в растворе серной кислоты. Напишите уравнения четырез описанных реакций
- Кристаллическое вещество желтого цвета сожгли в атмосфере кислорода . Полученный газообразный продукт поглотили раствором щелочи. А затем смешали с ратвором соляной кислоты, выделившийся газ растворили в избытке воды.
- Порошок алюминия сплавили с порошком оксида железа (III). Одно из полученных твердых веществ растворили в растворе щёлочи, а другое в растворе соляной кислоты. Выделившийся при этом газ пропустили над нагретым черным порошком оксида меди.
- Оксид алюминия растворили в соляной кислота. После прекращения химической реакции раствор обработали раствором едкого натра до выпадения белого студенистого осадка. Осадок отделили и прокалили , образовавшееся твердое вещество сплавили с кальцинированной содой . Запишите уравнения четырех описанных реакций.
- Газ полученный при сжигании кокса пропустили через раствор известкового молока , до выпадения осадка. Осадок отделили и прокалили. Образовавшееся твердое вещество сплавили с твердым оксидом цинка . Запишите уравнения четырех описанных реакций.
- Сульфид меди подвергли обжигу образовавшийся газ пропустили через раствор баритовой воды до образования прозрачного раствора. Раствор выпарили и прокалили . Твердое вещество из первой реакции при нагревании восстановили газообразным водородом. Запишите уравнения четырех описанных реакций.
- Нитрат цинка прокалили образовавшиеся твердое вещество смешали с твердым коксом и прокалили. Выделившийся газ сожгли в избытке кислорода, а твердое вещество растворили в концентрированной растворе щелочи . Запишите уравнения четырех описанных реакций.
- Через раствор гидроксида натрия пропустили избыток углекислого газа. Полученное при этом вещество выделили из раствора, высушили и прокалили. Выделяющийся газ пропустили над раскаленным углем, а затем над раскаленным оксидом меди. Запишите уравнения четырех описанных реакций

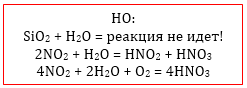
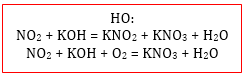
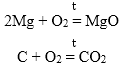
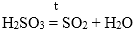
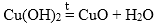
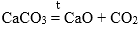

![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)


















