Структура ЕГЭ по химии: задания, уровни сложности и другая важная информация
Несмотря на то, что химия является экзаменом по выбору, это не умаляет его важности при поступлении на медицинские, экологические, биоинженерные и другие программы. ЕГЭ по этому предмету является восьмым по популярности предметом: в этом году его сдают 95 тысяч абитуриентов, а средний балл колеблется на уровне 53−54 баллов. Рассказываем о структуре ЕГЭ по химии 2022, чтобы ты смог основательно подготовиться к экзамену.
Основная информация о ЕГЭ 2022 по химии
Экзамен по химии состоит из двух частей. Первая включает 28 заданий, на которые нужно дать краткий ответ. Задания второй части (а их 6) открытого типа, на них необходимо ответить развёрнуто. На решение всех задач отводится 210 минут. Основной этап ЕГЭ по химии 2022 запланирован на 26 мая (четверг). Заявление на участие в этом экзамене тебе нужно было подать до 1 февраля. В содержании испытания планируются следующие изменения.
Как самостоятельно подсчитать баллы ЕГЭ: раскладываем систему по полочкам
Первая часть в ЕГЭ по химии: 28 заданий
Как мы отмечали выше, в первую часть включены 28 заданий, 8 из которых повышенной сложности. В них обычно просят выбрать один либо несколько правильных ответов из пяти предложенных или установить соответствие. В этом разделе экзамена ответы записываются в виде двух-трёх цифр. В задачах повышенного уровня необходимо находить ответы на нестандартные ситуации либо устанавливать соответствия между названием органического соединения и классом/группой, к которому (-ой) оно принадлежит; названием или формулой соли и отношением этой соли к гидролизу; исходными веществами и продуктами реакции между этими веществами; названием или формулой соли и продуктами, которые образуются на инертных электродах при электролизе её водного раствора, и т. д.
За правильное выполнение первой части заданий абитуриент может получить 36 первичных баллов из максимальных 56.
Вторая часть ЕГЭ: 6 заданий
Это самая сложная часть экзамена. На шесть заданий высокого уровня сложности необходимо дать развёрнутый ответ. Таким образом проверяется комплексное усвоение знаний на углубленном уровне: выполнение расчётов в химических реакциях различного вида, установление молекулярной и структурной формулы вещества и так далее.
За правильное решение этих 6 заданий можно получить 20 первичных баллов. В этом ты убедишься, когда порешаешь демовариант ЕГЭ по химии.
Что можно брать на ЕГЭ 2022 по химии?
На экзамене разрешено пользоваться линейкой; непрограммируемым калькулятором с возможностью вычисления тригонометрических функций (cos, sin, tg); периодической системой химических элементов Д.И. Менделеева; таблицей растворимости солей, кислот и оснований в воде; электрохимическим рядом напряжений металлов. Все другие предметы следует оставить за пределами аудитории.
Как оценивают результаты ЕГЭ по химии?
Ответы на задания первой части автоматически обрабатываются компьютером, а вторую часть проверяет предметная комиссия.
За правильный ответ на задания 1−5, 9−13, 16−21, 25−28 начисляется 1 балл. Задание считается выполненным верно, если абитуриент указал правильную последовательность цифр или число с заданной степенью точности.
Задания 6−8, 14, 15, 22−24 считаются выполненными верно, если правильно указана последовательность цифр. За полный ответ на каждое из вопросов 6−8, 14, 15, 22−24 ставится 2 балла; если допущена одна ошибка — 1 балл; за неверный ответ (более одной ошибки) или его отсутствие — 0 баллов.
Задания части 2 (с развёрнутым ответом) подразумевают проверку от двух до пяти элементов ответа. Наличие каждого обязательного элемента ответа оценивается в 1 балл, поэтому максимальная оценка задания составляет от 1 до 5 баллов в зависимости от степени сложности задания. Так, за задания 29 и 30 абитуриент получает 2 балла; 31 и 33 — 4 балла; 32 — 5 баллов; 34 — 3 балла.
Таким образом, вся сумма баллов (первичный балл) переводится в тестовый. Тестовый балл и есть результат Единого государственного экзамена.
Хочешь сдать ЕГЭ на максимально возможных балл? Тогда обрати внимание на сложные задания и записывайся на онлайн-курсы от Адукар. Удачи!
Спасибо, что дочитал до конца. Мы рады, что были полезны. Чтобы получить больше информации, посмотри ещё:
Онлайн-курсы подготовки к ЕГЭ
Каталог учебных заведений Адукар
Не пропускай важные новости и подписывайся на наш YouTube, ВК, Instagram, Telegram, Facebook и уведомления на adukar.by.
***
Если хотите разместить этот текст на своём сайте или в социальной сети, свяжись с нами по адресу info@adukar.by. Перепечатка материалов возможна только с письменного согласия редакции.
Хочешь быть в курсе новостей ЦТ?
Подписывайся на Адукар в соцсетях!
Начни подготовку к ЦТ и ЦЭ прямо сейчас!

Адукар обещает крутых преподавателей и много полезной практики.
итоговые занятия перед ЦТ? Такие занятия мы проводим уже четвёртый год, и преподаватели нашего учебного центра
научились достаточно точно предсказывать, какие вопросы будут на ЦТ. На этом занятии мы прорешаем их вместе с тобой!
Регистрируйся,
если еще не сделал этого — и увеличь свои шансы на поступление!
В 2022 г. в основной период ЕГЭ по химии приняло участие 83 482 человека. Средний тестовый балл ЕГЭ 2022 г. — 53,8 — сопоставим с аналогичными показателями ЕГЭ прошлых лет.
Результаты основного периода ЕГЭ 2022 г. свидетельствуют о некотором увеличении числа экзаменуемых, набравших максимальный балл (в 2022 г. — 691 человек, в 2021 г. — 556). Однако данный показатель относится исключительно к характеристикам выборки участников ЕГЭ конкретного года, и его изменение не имеет под собой надежных содержательных объяснений. Доля высокобалльников ЕГЭ 2022 г. по химии несущественно увеличилась в сравнении с экзаменами прошлых лет и составила 26,5%.
В целом результаты выполнения большинства заданий ЕГЭ 2022 г. сопоставимы с результатами выполнения аналогичных заданий в 2021 г.
Более подробные аналитические и методические материалы ЕГЭ 2022 года доступны по ссылке.
На нашем сайте представлены около 3000 заданий для подготовки к ЕГЭ по химии в 2023 году. Общий план экзаменационной работы представлен ниже.
ПЛАН ЭКЗАМЕНАЦИОННОЙ РАБОТЫ ЕГЭ ПО ХИМИИ 2023 ГОДА
читать полностью: спецификация.
Работа состоит из 34 заданий: заданий базового уровня сложности 17, повышенного — 11, высокого — 6. Максимальный первичный балл за работу — 56. Общее время выполнения работы — 210 мин.
Обозначение уровня сложности задания: Б — базовый, П — повышенный, В — высокий.
|
Проверяемые элементы содержания и виды деятельности |
Уровень сложности задания |
Максимальный балл за выполнение задания |
Примерное время выполнения задания (мин.) |
| Задание 1. Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов. |
Б |
1 |
2−3 |
| Задание 2. Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов |
Б |
1 |
2−3 |
| Задание 3. Электроотрицательность. Степень окисления и валентность химических элементов |
Б |
1 |
2−3 |
| Задание 4. Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения |
Б |
1 |
2−3 |
| Задание 5. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная) |
Б |
1 |
2−3 |
| Задание 6. Характерные химические свойства простых веществ – металлов: щелочных, щёлочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена |
П |
2 |
5−7 |
| Задание 7. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). Характерные химические свойства неорганических веществ |
П |
2 |
5−7 |
| Задание 8. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная); Характерные химические свойства неорганических веществ |
П |
2 |
5−7 |
| Задание 9. Взаимосвязь неорганических веществ |
П |
1 |
2−3 |
| Задание 10. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) |
Б |
1 |
2−3 |
| Задание 11. Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа |
Б |
1 |
2−3 |
| Задание 12. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории) |
П |
1 |
2−3 |
| Задание 13. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки |
Б |
1 |
2−3 |
| Задание 14. Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В. В. Марковникова) и радикальные механизмы реакций в органической химии |
П |
2 |
5−7 |
| Задание 15.Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений |
П |
2 |
5−7 |
| Задание 16. Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений |
П |
1 |
2−3 |
| Задание 17. Классификация химических реакций в неорганической и органической химии |
Б |
1 |
2−3 |
| Задание 18. Скорость реакции, её зависимость от различных факторов |
Б |
1 |
2−3 |
| Задание 19. Реакции окислительно-восстановительные |
Б |
1 |
2−3 |
| Задание 20. Электролиз расплавов и растворов (солей, щелочей, кислот) |
Б |
1 |
2−3 |
| Задание 21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная |
Б |
1 |
2−3 |
| Задание 22. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов |
П |
2 |
5−7 |
| Задание 23. Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ |
П |
2 |
5−7 |
| Задание 24. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений |
П |
2 |
5−7 |
| Задание 25. Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки |
Б |
1 |
2−3 |
| Задание 26. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе» |
Б |
1 |
3−4 |
| Задание 27. Расчёты теплового эффекта (по термохимическим уравнениям) |
Б |
1 |
3−4 |
| Задание 28. Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси |
Б |
1 |
3−4 |
| Задание 29. Окислитель и восстановитель. Реакции окислительно-восстановительные |
В |
2 |
10−15 |
| Задание 30. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена. |
В |
2 |
10−15 |
| Задание 31. Реакции, подтверждающие взаимосвязь различных классов неорганических веществ |
В |
4 |
10−15 |
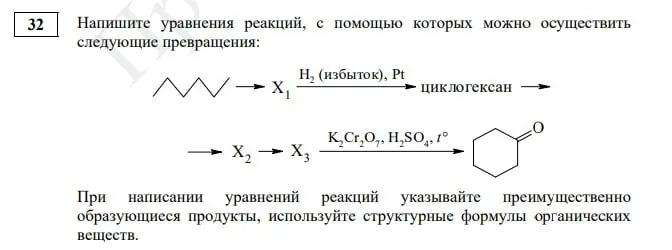
| Задание 32. Реакции, подтверждающие взаимосвязь органических соединений |
В |
5 |
10−15 |
| Задание 33. Установление молекулярной и структурной формул вещества |
В |
3 |
10−15 |
| Задание 34. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчёты массы (объёма, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определённой массовой долей растворённого вещества. Расчёты массовой доли (массы) химического соединения в смеси |
В |
4 |
20—25 |
ОФИЦИАЛЬНАЯ ШКАЛА 2022 ГОДА
Первичный балл
Тестовый балл
Соответствие между минимальными первичными баллами и минимальными тестовыми баллами 2022 года. Распоряжение о внесении изменений в приложение № 2 к распоряжению Федеральной службы по надзору в сфере образования и науки. Перейти.
ПОРОГОВЫЙ БАЛЛ
Для поступления в вузы, подведомственные Министерству науки и высшей школы: 39 тестовых баллов. См. приказ Миннауки.
Для поступления в вузы, подведомственные Министерству просвещения: 39 тестовых баллов. См. приказ Минпроса.
ЭКЗАМЕНАЦИОННЫЕ БЛАНКИ
Правила заполнения бланков государственной итоговой аттестации. Скачать бланки в высоком качестве можно по ссылке.
ЧТО МОЖНО ВЗЯТЬ С СОБОЙ НА ЭКЗАМЕН
На экзамене по химии разрешено применение непрограммируемого калькулятора; периодической системы химических элементов Д.И. Менделеева, таблицы растворимости солей, кислот и оснований в воде, электрохимического ряда напряжений металлов. Источник.
Авторы заданий для подготовки к ЕГЭ:
Д. Ю. Добротин,
А. А. Коверина,
Н. Г. Снастина;
материалы сайта Наука для тебя (автор Сергей Широкопояс), сайт http://ege.yandex.ru.
Распределение баллов ЕГЭ 2023 по химии за каждое задание можно узнать из демоверсии текущего года.
ЕГЭ 2023 химия. Баллы за каждое задание.
| Номер задания | Первичные баллы |
| 1 | 1 |
| 2 | 1 |
| 3 | 1 |
| 4 | 1 |
| 5 | 1 |
| 6 | 2 |
| 7 | 2 |
| 8 | 2 |
| 9 | 1 |
| 10 | 1 |
| 11 | 1 |
| 12 | 1 |
| 13 | 1 |
| 14 | 2 |
| 15 | 2 |
| 16 | 1 |
| 17 | 1 |
| 18 | 1 |
| 19 | 1 |
| 20 | 1 |
| 21 | 1 |
| 22 | 2 |
| 23 | 2 |
| 24 | 2 |
| 25 | 1 |
| 26 | 1 |
| 27 | 1 |
| 28 | 1 |
| Часть 2 | |
| 29 | 2 |
| 30 | 2 |
| 31 | 4 |
| 32 | 5 |
| 33 | 3 |
| 34 | 4 |
| Всего: | 56 |
Система оценивания выполнения отдельных заданий и экзаменационной работы ЕГЭ 2023 по химии в целом
Оценивание правильности выполнения заданий, предусматривающих краткий ответ, осуществляется с использованием специальных аппаратно-программных средств.
Правильное выполнение каждого из заданий 1–5, 9–13, 16–21, 25–28 оценивается 1 баллом. Задание считается выполненным верно, если ответ записан в той форме, которая указана в инструкции по выполнению задания, и полностью совпадает с эталоном ответа. В ответах на задания 1, 3, 4, 11, 12, 13, 17, 18 порядок записи символов значения не имеет.
Правильное выполнение каждого из заданий 6, 7, 8, 14, 15, 22, 23, 24 оценивается 2 баллами. Задание считается выполненным верно, если ответ записан в той форме, которая указана в инструкции по выполнению задания, и полностью совпадает с эталоном ответа: каждый символ в ответе стоит на своём месте, лишние символы в ответе отсутствуют. 1 балл выставляется, если на любой одной позиции ответа записан не тот символ, который представлен в эталоне ответа. Во всех других случаях выставляется 0 баллов. Если количество символов в ответе больше требуемого, выставляется 0 баллов вне зависимости от того, были ли указаны все необходимые символы. Развёрнутые ответы проверяются по критериям экспертами предметных комиссий субъектов Российской Федерации.
Задания части 2 (с развёрнутым ответом) предусматривают проверку от двух до пяти элементов ответа.
Задания с развёрнутым ответом могут быть выполнены выпускниками различными способами. Наличие каждого требуемого элемента ответа оценивается 1 баллом, поэтому максимальная оценка верно выполненного задания составляет от 2 до 5 баллов: за выполнение заданий 29 и 30 можно получить по 2 балла; за выполнение заданий 31 и 34 – по 4 балла; за выполнение задания 32 – 5 баллов; за выполнение задания 33 – 3 балла.
Проверка выполнения заданий части 2 осуществляется на основе поэлементного анализа ответа участника экзамена в соответствии с критериями оценивания выполнения задания.
Максимальный первичный балл за выполнение экзаменационной работы – 56.
На основе результатов выполнения всех заданий работы определяются первичные баллы, которые затем переводятся в тестовые по 100-балльной шкале.
Смотрите также:
В 2023 году ЕГЭ по химии пройдёт 26 мая в основной срок и 28 июня в резервные сроки. Рассказываем, как переводить первичные и итоговые баллы на экзамене.
Минимальное количество баллов для сдачи ЕГЭ по химии и получения аттестата — 36 тестовых баллов, что соответствует 11 первичным баллам. А максимальное количество первичных баллов, чтобы получить сотку — 56.
Напоминание: первичный балл — это балл за задание, а тестовый — сколько получится в итоге. Для большинства предметов используется шкала перевода баллов: один первичный балл соответствует нескольким тестовым. Причём скольким именно — зависит от всей суммы набранных баллов (см. таблицу перевода ниже). С минимальными баллами, порогами и проходными баллами разбирались в нашей статье.
Рассмотрим, каков вес каждого задания.
Как изменились задания по сравнению с прошлым годом? Разбираем новую демоверсию вместе с Таисией Фламель.
Количество баллов за тестовые задания в ЕГЭ по химии
Первая часть: 28 заданий с кратким ответом. За правильное выполнение всех заданий вы получите 36 первичных баллов. Это 69 итоговых тестовых баллов.
1 балл: задания 1–5, 9–13, 16–21, 25–28
2 балла: задания 6, 7, 8, 14, 15, 22, 23, 24
Сколько баллов весит задание с развёрнутым ответом
Вторая часть: 6 заданий с развёрнутым ответом. Максимальный первичный балл — 20. Без учёта тестовых заданий это 48 итоговых баллов. Ну, мало ли, вы решите начать со сложного на экзамене 🙂
2 балла: задания 29 и 30
3 балла: задание 33
4 балла: задания 31 и 34
5 баллов: задание 32
Шкала перевода баллов ЕГЭ по химии в 2023 году:
| Первичный балл | Тестовый балл |
| 1 | 4 |
| 2 | 7 |
| 3 | 10 |
| 4 | 14 |
| 5 | 17 |
| 6 | 20 |
| 7 | 23 |
| 8 | 27 |
| 9 | 30 |
| 10 | 33 |
| 11 | 36 |
| 12 | 38 |
| 13 | 39 |
| 14 | 40 |
| 15 | 42 |
| 16 | 43 |
| 17 | 44 |
| 18 | 46 |
| 19 | 47 |
| 20 | 48 |
| 21 | 49 |
| 22 | 51 |
| 23 | 52 |
| 24 | 53 |
| 25 | 55 |
| 26 | 56 |
| 27 | 57 |
| 28 | 58 |
| 29 | 60 |
| 30 | 61 |
| 31 | 62 |
| 32 | 64 |
| 33 | 65 |
| 34 | 66 |
| 35 | 68 |
| 36 | 69 |
| 37 | 70 |
| 38 | 71 |
| 39 | 73 |
| 40 | 74 |
| 41 | 75 |
| 42 | 77 |
| 43 | 78 |
| 44 | 79 |
| 45 | 80 |
| 46 | 82 |
| 47 | 84 |
| 48 | 86 |
| 49 | 88 |
| 50 | 90 |
| 51 | 91 |
| 52 | 93 |
| 53 | 95 |
| 54 | 97 |
| 55 | 99 |
| 56 | 100 |
Шкала перевода баллов может незначительно поменяться, однако содержание экзаменационных заданий на 2023 год уже утверждено. Демоверсию, кодификатор и специализацию к ЕГЭ по химии ищите на сайте ФИПИ.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Химия — один из самых сложных предметов для сдачи ЕГЭ. Задания меняются каждый год: то, что раньше казалось трудным, нынешние выпускники должны успевать за пару минут. Несмотря на это экзамен необходим будущим врачам, фармацевтам и, конечно же, химикам. Давайте обсудим, как устроен ЕГЭ по химии 2023 и что нужно выучить для успешной сдачи!
Структура ЕГЭ по химии 2023
ЕГЭ по химии состоит из двух частей. В первой выпускникам предлагают решить 28 заданий — нужен краткий ответ в виде одного числа или последовательности чисел. Во второй части — 6 заданий с развернутым ответом. В них нужно записывать уравнения химических реакций и решать сложные математические задачи. Если выполнить работу без ошибок, можно набрать 56 первичных баллов.
Нововведение ЕГЭ по химии 2023 — сокращение количества заданий и появление новых прототипов.
Изменения в ЕГЭ по химии 2023
Задание № 23. В прошлом году ребята впервые решали задание на расчет равновесных и исходных концентраций. Оно представляло собой уравнение химической реакции, а также таблицу с концентрациями каждого участника. В этом году таблицы не будет, вместо нее предлагается найти исходные данные в тексте. Советуем вам не отходить от уже отработанного алгоритма и самостоятельно составлять таблицы. Немного практики и навык владения калькулятором помогут получить за этот номер максимальные баллы даже с новым условием.
Задания № 9, 12 и 16. Эти задания не изменились на вид. В №9 и 16 предстоит разобраться с небольшими цепочками превращений – неорганической и органической соответственно. А в задании 12 выпускников вновь ожидают химические свойства органических веществ и неизвестное количество правильных ответов. Но в этом году задания станут сложнее, их переносят в разряд заданий повышенного уровня сложности. К сожалению, при неизменном 1 балле за каждый из номеров.
Задания № 33 и 34. Каждый выпускник накануне ЕГЭ по химии очень хочет знать, чему будут посвящены задачи 33 и 34. Конечно же, тайну нам не открыли, но зато эти задания поменяли местами. Теперь №33 – это задача на установление органической формулы, а №34 – сложная расчетная задача, основанная на неорганических превращениях.
Задание № 32. Эта органическая цепочка существенно не изменилась, ребятам предстоит записать пять уравнений химических реакций. Но стоит обратить пристальное внимание на изображение гексана, с такими формулами мы в ЕГЭ еще не сталкивались, но есть вероятность, что видеть их мы теперь будем чаще.
Это главные изменения ЕГЭ по химии 2023. Но для того, чтобы получить высокий балл, просто знать о них недостаточно. Когда ФИПИ обновляет формулировки заданий, может измениться и способ их решения и критерии оценивания. Если не учитывать это во время подготовки к ЕГЭ, то можно потерять немало баллов. Обидно!
Это — лишь малая часть ловушек экзамена, которые составители расставляют выпускникам. На своих занятиях по подготовке ЕГЭ по химии я показываю ученикам их все. Мы учимся обходить каждую из них и делать такие решения заданий, к которым никто не придерется. А еще я всегда делюсь лайфхаками быстрого и правильного решения типичных задач — так можно сэкономить много времени на более сложные вещи.
Всему этому я могу научить и вас! Приходите ко мне на уроки, и я подготовлю вас к ЕГЭ по химии на 80+ 💪🤓
Какие темы есть в ЕГЭ по химии?
Чтобы успешно сдать ЕГЭ по химии 2023, нужно освоить пять разделов этой науки.
Теоретические основы химии
Этот блок включает в себя информацию о строении атомов, об их существовании в молекулах вещества. Выпускникам нужно продемонстрировать навыки работы с таблицей химических элементов Д.И. Менделеева. Этот раздел поможет решить задания 1-4, 18-20, 23 в первой части, а также задание 29 во второй части.
Неорганическая химия
Этой теме посвящены задания 5-9, 17, 21 (первая часть), 30, 31 (вторая часть). Вас ждут любые свойства неорганических соединений: от простых веществ-металлов и неметаллов до комплексных солей и кристаллогидратов. Чтобы получить высокие баллы, необходимо также знать правила номенклатуры, способы получения и основы процессов гидролиза и электролиза.
Органическая химия
В заданиях 10-16 и 32 вы столкнетесь с органической химией. Ученики, которые готовятся самостоятельно, часто стараются выучить все классы веществ по стандартному плану: название класса, номенклатура, физические и химические свойства, способы получения и применение. На самом деле можно значительно облегчить себе жизнь и начать со строения органических молекул. Как только вы поймете, что кратные связи можно разорвать одним набором реактивов, в группе –ОН замещают атом водорода, а –NH2 группа реагирует с кислотами, классы органических веществ и их реакции покажутся однотипными.
Химия и жизнь
Название этого раздела кажется простым и понятным. К сожалению, именно здесь ученики чаще всего теряют баллы. В задании 24 необходимо мысленно представить эксперимент и написать, что произойдет при смешивании заданных веществ. Например, может выпасть осадок, выделиться газ, а может вообще ничего не произойти. В задании 25 нужно определить, где используют то или иное химическое соединение. Ответом может быть химическая промышленность, медицина, сельское хозяйство и, конечно, повседневная жизнь человека.
Решение расчетных задач
Очень важная часть экзамена по химии. В заданиях 26, 27 и 28 в первой части нужно дать ответ в виде числа, не записывая решение. Обычно эти задачи решаются в одно действие — они проверяют не знания химических процессов, а навыки работы с калькулятором.
Задание 34, по мнению многих учеников — самое сложное во всем экзамене. Чтобы его решить, нужно знать химические свойства веществ, уметь составлять причинно-следственные связи в химических системах, понимать, какие вещества реагируют без остатка и почему. Кроме того, в последние годы все чаще встречаются задачи, которые необходимо решать с помощью линейных уравнений или их систем.
В задаче 32 нужно выполнить расчеты, которые позволят установить молекулярную формулу некоторого органического вещества. Далее, используя описание, необходимо представить эту формулу в структурном виде, показывая связи между атомами. Обязательно запишите в ответе уравнение реакции, о которой идет речь в условии!
Как подготовиться к ЕГЭ по химии 2023?
По структуре экзамена видно, что вам придется повторить или освоить заново весь курс химии за год. С какой темы начать? За что взяться в первую очередь?
Скачайте кодификатор по химии 2023 года. Обычно он находится вместе в демоверсией. В этом документе перечислены все темы, которые необходимо хорошо подготовить. Этот перечень охватывает все задания ЕГЭ, в нем нет ничего лишнего.
Подружитесь с таблицами. Периодическая система химических элементов Д. И. Менделеева, таблица растворимости кислот, солей и оснований, ряд активности металлов – это отличные шпаргалки, которые раздают вместе с вариантами на ЕГЭ. Если правильно ими воспользоваться, можно не только понять, протекает ли реакция между веществами, но даже установить среду раствора, силу кислоты и цвет осадка. И это еще не все!
Грамотно распределите время. Учите теорию, но и не забывайте практиковаться. Если вы не нарешаете тренировочных вариантов, время может сыграть злую шутку на реальном экзамене. 210 минут не хватает на размышления, решения, красивую запись и перепроверку. Необходимо работать в хорошем темпе!
Не оставляйте подготовку на конец года. Несмотря на распределение заданий по разделам химии, старайтесь решать их с самого начала подготовки, постепенно усложняя условия. И помните, что задачи второй части ЕГЭ оцениваются по критериям. Даже если вы не знаете, как решить задание полностью, вы всегда можете заработать 1-2 первичных балла, записав без ошибок уравнения химических реакций и проведя простейшие расчеты.
Прорешивайте как можно больше заданий. Это, пожалуй, самый главный совет. Чем больше вы будете тренироваться и решать типовые задачи, тем выше шансы получить на экзамене высокий балл. Все потому, что вы поймете алгоритм решения и сможете находить правильный ответ намного быстрее, чем другие выпускники.
Когда я готовлю к ЕГЭ по химии в MAXIMUM Education, мы посвящаем немало времени решению всех заданий экзамена. Мы разбираем все части экзамена и учимся правильно оформлять ответы, чтобы не потерять ни одного балла. Чтобы проверить, все ли понятно ученикам, я провожу срезы знаний и даже пробный экзамен. После него я разбираю ошибки с каждым учеником отдельно, и дополнительно объясняю сложные темы.
После такой подготовки мои выпускники пишут настоящий экзамен уверенно и получают высокие баллы. Точно выше среднего балла по стране 🙃 Хотите так же? Приходите на мои занятия, и я научу вас всему, что знаю!
Рассмотрим изменения в ЕГЭ 2022 года по химии, представленных ФИПИ:
-
В экзаменационном варианте общее количество заданий уменьшено с 35 до 34. Это достигнуто в результате объединения контролируемых элементов содержания, имеющих близкую тематическую принадлежность или сходные виды деятельности при их выполнении.
-
Элементы содержания «Химические свойства углеводородов» и «Химические свойства кислородсодержащих органических соединений» (в 2021 г. – задания 13 и 14) будут проверяться заданием 12. В обновлённом задании будет снято ограничение на количество элементов ответа, из которых может состоять полный правильный ответ.
-
Исключено задание 6 (по нумерации 2021 г.), так как умение характеризовать химические свойства простых веществ и оксидов проверяется заданиями 7 и 8.
-
Изменён формат предъявления условий задания 5, проверяющего умение классифицировать неорганические вещества, и задания 21 (в 2021 г. – задание 23), проверяющего умение определять среду водных растворов: в текущем году потребуется не только определить среду раствора, но и расставить вещества в порядке уменьшения/увеличения кислотности среды (рН).
-
Включено задание (23), ориентированное на проверку умения проводить расчёты на основе данных таблицы, отражающих изменения концентрации веществ.
-
Изменён вид расчётов в задании 28: требуется определить значение «выхода продукта реакции» или «массовой доли примеси».
-
Изменена шкала оценивания некоторых заданий в связи с уточнением уровня их сложности и количеством мыслительных операций при их выполнении. В результате этого максимальный балл за выполнение работы в целом составит 56 баллов (в 2021 г. – 58 баллов).
Изменение содержания заданий ЕГЭ-2022 по химии
Единый государственный экзамен (ЕГЭ) является одной из форм государственной итоговой аттестации учащихся и проводится в соответствии с Федеральным законом об образовании Российской федерации. Общее содержание экзаменационной работы соответствует федеральному государственному образовательному стандарту. В 2022 году будут сдавать ЕГЭ учащиеся, которые, начиная с первого класса, обучались в соответствии с ФГОС. По этой причине по всем предметам, в том числе и по химии, происходит изменение содержания экзаменационных материалов; это изменение будет осуществлено в 2022 и 2023 годах.
Общая характеристика работы
Экзаменационная работа состоит из двух частей.
Первая часть содержит 28 заданий с кратким ответом, среди них 20 заданий базового уровня сложности, каждое из которых при правильном выполнении оценивается в 1 первичный тестовый балл (задания 1-5, 9-13, 16-21, 25-28), и 8 заданий повышенного уровня сложности, каждое из которых максимально может быть оценено в 2 балла (задания 6-8, 14, 15, 22-24, 26).
Вторая часть включает 6 заданий с развёрнутым ответом высокого уровня сложности.
Таблица 1
|
Уровень сложности |
Номера заданий |
Максимальный первичный балл / % от максимального первичного балла за работу |
|
1-я часть
|
||
| Базовый | 1-5, 9-13, 16-21, 25-28 | 20 / 35,7 |
| Повышенный | 6-8, 14, 15, 22-24, 26 | 16 / 28,6 |
| Всего: | 36 / 64,3 | |
|
2-я часть |
||
| Высокий | 29 | 2 / 3,6 |
| 30 | 2 / 3,6 | |
| 31 | 4 / 7,1 | |
| 32 | 5 / 8,9 | |
| 33 | 4 / 7,1 | |
| 34 | 3 / 5,4 | |
| Всего: | 20 / 35,7 | |
| Итого: | 56 |
Распределение заданий и максимальный первичный балл за выполнение задания
В таблице 2 проводится сопоставление формата заданий теста ЕГЭ-2022 по химии по сравнению с 2021 г.
|
Номер вопроса в ЕГЭ-2022 |
Номер вопроса в ЕГЭ-2021 |
Комментарий |
| 1-4 | 1-4 | Совпадение по форме и содержанию |
| 5 | 5 | Новая форма вопроса |
| 6 | 7 | Совпадение |
| 7 | 8 | Совпадение |
| 8 | 9 | Совпадение |
| 9 | 10 | Совпадение |
| 10 | 11 | Совпадение |
| 11 | 12 | Совпадение |
| 12 | 13, 14 | Новая форма вопроса |
| 13 | 15 | Совпадение |
| 14 | 16 | Совпадение |
| 15 | 17 | Совпадение |
| 16 | 18 | Совпадение |
| 17 | 19 | Совпадение |
| 18 | 20 | Совпадение |
| 19 | 21 | Совпадение |
| 20 | 22 | Изменение формы вопроса |
| 21 | — | Новая форма вопроса |
| 22 | 24 | Совпадение |
| 23 | — | Новая форма вопроса |
| 24 | 25 | Совпадение |
| 25 | 26 | Совпадение |
| 26 | 27 | Совпадение |
| 27 | 28 | Совпадение |
| 28 | Новая форма вопроса | |
| 29 | 30 | Совпадение |
| 30 | 31 | Совпадение |
| 31 | 32 | Совпадение |
| 32 | 33 | Совпадение |
| 33 | 34 | Совпадение |
| 34 | 35 | Совпадение |
Выводы
-
Уменьшилось число вопросов с 35 до 34. Это произошло в результате исключения вопроса 6 (ЕГЭ-2021) и объединения вопросов 13 и 14 в один вопрос и добавления вопроса 23.
-
Уменьшился максимальный первичный балл с 58 до 56. Это произошло в результате исключения вопроса 6 (базовый уровень сложности, уменьшение на 1 балл), объединения вопросов 13 и 14 (базовый уровень сложности, уменьшение на 1 балл), снижения уровня сложности вопросов 20 и 21 с повышенного на базовый (уменьшение на1 балл каждого).
-
Принципиально изменились вопросы 5 (классификация неорганических веществ), 12 (свойства углеводородов и их функциональных производных), 21 (понятие о кислотности среды), 23 (расчёт характеристики химического равновесия с использованием табличной формы представления данных), 28 (расчётная задача базового уровня сложности).
Пособие «Химия. ЕГЭ-2022. Тематический тренинг. Задания базового и повышенного уровней сложности» от издательства Легион разработано с учетом изменений ФИПИ 2022 года.
Примеры новых заданий в егэ по химии 2022 года
Вопрос 5:
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) двухоснóвной кислоты; Б) средней соли; В) амфотерного гидроксида
1
NaH2PO42
Zn(OH)23
HNO24
H2SO35
H3P6
ZnO7
Zn8
NH4NO39
Fe(OH)2
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.

Базовые знания
Гидроксидами называются вещества, которые соответствуют оксидам. Оснóвным оксидам соответствуют оснóвные гидроксиды (основания), амфотерным – амфотерные гидроксиды, кислотным – кислородсодержащие кислоты.
Амфотерным оксидам соответствуют амфотерные гидроксиды. Амфотерные оксиды образуют атомы металлов в степенях окисления +3 или +4; амфотерными являются оксиды ZnO, BeO, Al2O3, Cr2O3, Fe2O3 и оксиды некоторых других металлов.
Zn(OH)2 = ZnO + H2O2Fe(OH)3 = Fe2O3 + 3H2O
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотного остатка. По составу кислотного остатка кислоты классифицируют на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCl, H2S, HCN), по числу атомов водорода — на одноосно́вные (HF, HCl, HCNS) и многоосно́вные (H2CO3, H3PO4).
Солями называются продукты полного или частичного замещения атомов водорода в кислотах на катионы металла или группы NH4+ или, другими словами, соли – электролиты, при диссоциации которых образуются катионы металла (или аммония) и анионы кислотного остатка.
Соли классифицируют на:
а) средние, например: К2SO3 – сульфит калия, CuCl2 – хлорид меди(II);
б) оснóвные, например: CuOHCl – гидроксохлорид меди(II), FeOH(NO3)2 – гидроксонитрат железа(III);
в) кислые, например: NaHSO4 – гидросульфат натрия, Ca(HCO3)2 – гидрокарбонат кальция;
г) комплексные, в состав которых входит сложный катион или анион, состоящий из атома металла-комплексообразователя и лигандов, например: Na[Al(OH)4] – тетрагидроксоалюминат натрия, [Ag(NH3)2]ОН – гидроксид диамминсеребра(I).
Анализ и решение
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ и, во-вторых, правильно записать ответ.
- NaH2PO4 – состоит из атомов натрия и остатка фосфорной кислоты H3PO4, класс солей. В кислотном остатке имеются атомы водорода, следовательно, соль – кислая. Ответ неверный.
- Zn(OH)2 – состоит из атомов цинка (металл) и гидроксильных групп, класс гидроксидов. Гидроксид цинка – амфотерный гидроксид (обязан знать). Ответ В – 2.
- HNO2 – азотистая кислота (обязан знать). Одноосно́вная кислородсодержащая кислота. Ответ неверный.
- H2SO3 – сернистая кислота (обязан знать). Двухосно́вная кислородсодержащая кислота. Ответ А – 4.
- H3P – летучее водородное соединение (фосфин). Ответ неверный.
- ZnO – оксид цинка, амфотерный оксид. Ответ неверный.
- Zn – металл. Ответ неверный.
- NH4NO3 – состоит из групп NH4 и остатка азотной кислоты HNO3. Соль средняя. Ответ Б – 8.
Вывод: правильные ответы найдены. Оставшийся вариант рассматривать не будем.
Ответ: 428.
Вопрос 12:
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории).
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в кислой среде образуется карбоновая кислота.
- гексен-1
- бензол
- метилбензол
- этилацетат
- уксусный альдегид
Запишите номера выбранных ответов.
Ответ: _______ .
Базовые знания
В кислой среде раствор перманганата калия KMnO4 способен окислять спирты, альдегиды, непредельные углеводороды (алкены, алкины, диены) и их производные, боковые цепи ароматических углеводородов.
Анализ и решение
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ, во-вторых, проверить возможность протекания реакции и, в третьих, правильно записать ответ.
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ, во-вторых, проверить возможность протекания реакции и, в третьих, правильно записать ответ.
1) Гексен-1 – алкен, должен реагировать с подкислённым раствором перманганата калия с разрывом кратной связи и образованием углекислого газа и валериановой кислоты.
CH3(CH2)3–CH=CH2 + KMnO4 + H2SO4 → CH3(CH2)3–COOH + CO2 + K2SO4 + MnSO4 + H2O
Вывод: ответ 1 – правильный.
2) Бензол. Не окисляется раствором KMnO4.
C6H6 + KMnO4 ≠
Вывод: ответ 2 – неверный.
3) Метилбензол, или толуол, — C6H5–CH3. Возможно окисление группы CH3.
C6H5–CH3 + KMnO4 → C6H5–COOH + K2SO4 + MnSO4 + H2O
Вывод: ответ 3 – правильный.
4) Этилацетат CH3COOC2H5 – сложный эфир. Не должен окисляться раствором KMnO4/
CH3COOC2H5 + KMnO4 ≠
Вывод: ответ неверный.
5) Уксусный альдегид CH3CHO, должен окисляться раствором KMnO4.
CH3CHO + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
Ответ: 135.
Вопрос 21:
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
- Na2SO4
- Fe(NO3)2
- K2SO3
- НClO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Базовые знания
При растворении электролита в воде происходит его взаимодействие с молекулами воды. В результате происходит диссоциация электролита, смещается положение равновесия диссоциации воды и изменяется кислотность среды.
При растворении кислот в результате их диссоциации образуются катионы H+ и среда становится кислой, pH < 7. В растворах сильных кислот концентрация катионов H+ больше, чем в растворах более слабых кислот, и величина pH меньше. Например, в растворах с концентрацией 0,1 моль/л для соляной кислоты pH ≈ 1, для уксусной кислоты рН ≈ 2,9.
При растворении щелочей образуется большое количество гидроксид-ионов OH–, pH > 7.
При диссоциации солей образующие их катионы и анионы будут взаимодействовать с молекулами воды. Гидролизом называется реакция обменного взаимодействия соли и воды, в результате протекания которой смещается положение равновесия диссоциации воды и изменяется кислотность среды. Степень гидролиза, как правило, составляет доли процента и только в отдельных случаях достигает заметных значений. Наиболее выражены процессы гидролиза солей, в состав которых входят катионы слабых оснований и/или анионы слабых кислот. В растворах солей, в состав которых входят катионы слабых оснований, среда кислая, pH < 7. В растворах солей, в состав которых входят анионы слабых кислот, среда щелочная, pH > 7. Чем более слабым является основание или кислота, образующие соль, тем больше будет степень гидролиза и больше изменение кислотности среды и величины pH. Например, для раствора AlCl3 с молярной концентрацией 0,1 моль/л рН ≈ 3,1, раствора NH4Cl ≈ 5.
Вывод:
- необходимо определить классы веществ и возможность протекания гидролиза по формулам веществ;
- в растворах растворимых оснований среда щелочная, в растворах кислот – кислая, причем концентрация катионов H+ в растворах более слабых кислот будет меньше, а величина рН – больше;
- определить относительную силу катионов, взаимодействующих с водой: кислотность среды будет тем больше отклоняться от нейтральной в кислую сторону (следовательно, рН меньше), чем более слабым основанием образована соль;
- определить относительную силу анионов, взаимодействующих с водой: кислотность среды будет тем больше отклоняться от нейтральной в щелочную сторону (следовательно, рН больше), чем более слабой кислотой образована соль;
- для солей, которые образованы сильными основаниями и сильными кислотами условно будем считать среду нейтральной.
Решение
- Na2SO4 – сульфат натрия. Средняя соль, образована сильным основанием NaOH и сильной средней кислотой, гидролизу не подвергается. Среда – приблизительно нейтральная
- Fe(NO3)2 – нитрат железа(II). Средняя соль, образован слабым основанием Fe(OH)2 и сильной азотной кислотой HNO3. Гидролиз по катиону Fe2+, среда – кислая.
- K2SO3 – сульфит калия. Средняя соль, образована сильным основанием KOH и кислотой средней силы H2SO3. Гидролиз по кислотному остатку (по аниону), среда – щелочная.
- НClO3 – хлорноватая кислота. Сильная кислота. Среда – кислая.
Понятно, что концентрация катионов H+ будет наибольшей в растворе HClO3, следовательно, pH этого раствора будет иметь наименьшее значение.
Кислотность раствора Fe(NO3)2 будет меньше, чем раствора HClO3, потому что степень гидролиза редко бывает большой.
В растворе K2SO3, имеющем щелочную среду, величина pH будет наибольшей.
Вывод: величина рН будет увеличиться в последовательности
HClO3 < Fe(NO3)2 < Na2SO4 < K2SO3
Ответ: 4213.
Вопрос 23:
Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.
В реактор постоянного объёма поместили некоторое количество оксида серы(IV) и кислорода. В результате протекания обратимой реакции в реакционной системе
2SO2(г) + O2(г) ⇄ 2SO3(г)
установилось химическое равновесие.
Используя данные, приведённые в таблице, определите серы (X) и исходную концентрацию кислорода (Y).
Реагент SO2(г) O2(г) SO3(г) Исходная концентрация, моль/л 0,6 Равновесная концентрация, моль/л 0,3 0,4
Выберите из списка номера правильных ответов.
Анализ и решение
Пусть объём системы V = 1 л, тогда изменение концентрации численно равно изменению количества вещества.
1) Вычисляем изменение количества вещества одного из реагентов (SO3):
∆n(SO3) = 0,4 – 0 = 0,4 моль
2) По изменению концентрации SO3 по уравнению реакции вычисляем количество вещества, вступившее в реакцию, других реагентов (SO2 и O2):

3) Вычисляем количество вещества оксида серы(IV) в состоянии равновесия и исходное количество кислорода:
n(SO2)равн. = 0,6 – 0,4 = 0,2 моль
n(O2)исх. = 0,3 + 0,2 = 0,5 моль
и переносим в таблицу (показаны полужирным шрифтом).
Вывод: X = 0,2 моль/л (2), Y = 0,5 моль/л (5).
Ответ: 25.
Вопрос 28:
Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси.
Из 150 кг природного известняка при взаимодействии с азотной кислотой был получен нитрат кальция массой 196,8 кг. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до целых.)
Ответ: ____ %.
Базовые знания
Решение любой расчётной задачи по химии подчиняется достаточно строгому алгоритму.
1) Составить уравнение реакции.
2) Понять главный вопрос задачи.
3) Установить логическую связь: количество какого из веществ необходимо найти, по количеству какого вещества производим расчёт.
4) Произвести расчёты и ответить на главный вопрос задачи.
Решение:
1) Составляем уравнение реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑
2) Главный вопрос задачи – найти массовую долю примесей в известняке.
Массовая доля вычисляется по формуле
ω = mчасти/mвсего образца
Массовая доля примесей
ω(примеси) = 100% — ω(CaCO3),
Вывод: необходимо найти количество CaCO3, расчёт производим по Ca(NO3)2.
3) Производим расчёт и находим количество и массу CaCO3.

а) находим количество Ca(NO3)2
M(Ca(NO3)2) = 164 г/моль
n(Ca(NO3)2) = m/M = 196,8/164 = 1,2 моль
б) находим количество и массу CaCO3
x = 1∙1,2/1 = 1,2 моль CaCO3
M(CaCO3) = 100 г/моль, m(CaCO3) = 1,2∙100 = 120 г
4) Находим массовую долю примесей.
ω(CaCO3) = 120/150 = 0,8, или 80%
ω(примеси) = 100 – 80% = 20%.
Ответ: 20.

РЕКОМЕНДУЕМЫЕ ТОВАРЫ
Сдавать ЕГЭ по химии можно по выбору. Результаты экзамена по этому предмету требуются при поступлении на целый ряд направлений. В частности, они понадобятся, если вы решите поступить на лечебное дело и фармакологию, экологию, природопользование и некоторые другие специальности. В последние годы количество участников ЕГЭ, выбравших химию в качестве дополнительного предмета, только растёт. Выпускники школ хорошо справляются с традиционными задачами, но некоторые задания экзамена вызывают немало трудностей.

Коротко о ЕГЭ по химии
- Время на выполнение экзаменационной работы – 210 минут.
- Минимальный балл для получения возможности поступить в вуз – 36.
- Экзаменационная работа – 2 части, 35 заданий.
Структура экзамена
Первая часть экзамена по химии состоит из 29 заданий, в которых нужно дать краткий ответ. Из них 21 задание имеет базовый, остальные 8 – повышенный уровень сложности.
Во второй части экзамена содержится 6 заданий, в которых нужно дать развёрнутый ответ – 30-35 задания. В прошлом году экзаменационная работа пополнилась новым заданием с развёрнутым ответом. При этом 30 и 31 задачи объединены общим контекстом.
Во время решения задач можно прибегать к помощи непрограммируемого калькулятора. Использовать какие-либо средства связи запрещено. Но участник экзамена получает:
- таблицу растворимости;
- таблицу Менделеева;
- ряд активности металлов.
Рекомендации для участников экзамена
- Перед началом экзамена, прежде всего, следует прочитать инструкцию к работе. Кроме того, важно внимательно ознакомиться с формулировкой заданий и тщательно обдумать ответы на них.
- Заполнять лист для ответов на задания первой части следует в строгом соответствии с образцом начертания цифр и букв. Дело в том, что эти ответы будут проверяться автоматически.
- Расчёт по уравнению реакций нужно выполнять в молях, в противном случае решение не будет зачтено.
- Записывать ответы нужно максимально разборчиво, иначе можно не досчитаться нескольких баллов.
- Во время выполнения заданий рекомендуется записывать химические формулы и уравнения реакций – даже в том случае, если это требование не прописано в условии.
- При выполнении заданий, которые проверяют то, насколько хорошо выпускники изучили генетическую взаимосвязь неорганических веществ, требуется написать уравнения четырёх реакций. Важно принять во внимание не только общие, но и специфические свойства веществ, которые участвуют в реакции. Также нужно учесть условия протекания реакций между ними.
- Большие трудности вызывают задания №25 и №26. Первое проверяет знания о качественных реакциях на неорганические и органические вещества, второе – о способах получения и областях применения веществ. Чтобы выполнить их, нужно владеть практико-ориентированной составляющей школьного курса химии.
- Наиболее сложной на протяжении последних лет является задача №34. Она включает в себя расчёт по уравнениям и формулам химических реакций. При выполнении этого задания (как и некоторых других) нужно уметь выделять в условии необходимую для решения информацию и анализировать её.
- Особое внимание следует уделить заданиям, входящим во вторую часть ЕГЭ по химии. Ответ на них должен быть чётко сформулированным и логически выстроенным. Нужно дать ответы на все те вопросы, что предусмотрены условием.
Как подготовиться?
- Найдите человека, которому можно было бы задавать вопросы. Вовсе не обязательно, чтобы это был репетитор. Этим человеком может быть учитель по химии или знакомый студент, который отлично знает данный предмет. Не стоит стесняться задавать даже вопросы с очевидными ответами, т.к. ваша цель – постараться закрыть все пробелы.
- Записываясь на курсы, отдайте предпочтение мини-группе, которая состоит из 3-4 учащихся. Возможность задавать вопросы в таком случае будет появляться в любой момент. В стандартных группах такой возможности у вас не будет.
- Научитесь эффективно работать с теорией. Мало просто читать теоретический материал и запомнить его. В ходе его изучения нужно выписывать в тетрадь всё самое главное: определения, таблицы и схемы. Также нужно стараться самостоятельно выводить формулы.
- Нужно научиться пользоваться таблицей Менделеева. Изучите валентность, степень окисления, металлические, неметаллические и прочие периодические свойства элементов. Благодаря этому вы без труда найдёте ответы на некоторые задания в этой таблице.
- Повторяйте математику, т.к. химию без неё не сдать. Но в целом формул, которые потребуются для решения задач, не так уж и много. Вам понадобятся только основные: формула для расчёта количества вещества, плотности, массовой доли и некоторые другие.
Где найти демонстрационную версию?
Если вы хотите попробовать свои силы, то ознакомьтесь с демоверсиями ЕГЭ-2019 по химии. Найти их можно на сайте ФИПИ. С их помощью вы получите примерное представление о структуре будущих вариантов КИМ и форме заданий. Там же можно ознакомиться с кодификатором и спецификацией КИМ.