По теме: методические разработки, презентации и конспекты
Итоговая контрольная работа по химии 9 класс
На протяжении многих лет использую в своей работе технологию уровневой дифференциации, разработанную исходя из принципа достижения обязательных результатов обучения. Предлагаю вариант итоговой контрол…
итоговая контрольная работа по химии 8 класс
Данная контрольная работа является итоговой за курс 8 класса. Состоит из двух вариантов и включает задания: части А ( с выбором ответа), части В ( установление соответствий) и части С (с полным ответо…
Контрольно-измерительный материал по химии
для проведения переводного экзамена в 8 классе
2018/2019 учебный год
Инструкция по выполнению работы
Экзаменационная работа включает в себя 10 заданий. На
выполнение работы отводится 2 часа (120 минут). Ответы к заданиям записываются
в виде цифры или последовательности цифр. Все бланки заполняются черной гелевой
ручкой.
Вариант 1
Часть 1
1. Химическому элементу, степень
окисления которого в высшем оксиде +6, соответствует схема распределения
электронов в атоме:
1) 2, 8, 6
2) 2, 8, 8, 2
3) 2, 8, 3
4) 2, 6
2. В каком ряду химических элементов
усиливаются металлические свойства соответствующих им простых
веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
3. В каком из соединений
степень окисления азота равна −3?
1)
2)
3)
4)
4. К окислительно-восстановительным
относится реакция термического разложения
1)
2)
3)
4)
5. Наибольшее число анионов образуется
при полной диссоциации 1 моль
1) фосфата калия
2) нитрата натрия
3) сульфата меди(II)
4) хлорида железа(III)
6. Верны ли следующие суждения об
обращении с растворами щелочей?
А. При попадании раствора щелочи на кожу
рук его надо смыть водой.
Б. При попадании раствора щелочи на кожу
рук его надо смыть раствором соды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. На диаграмме изображено
распределение массовых долей водорода, азота и кислорода в некотором
веществе.
Какому веществу оно соответствует?
1)
2)
3)
4)
8. При выполнении задания из
предложенного перечня ответов выберите два правильных и запишите цифры, под
которыми они указаны.
В ряду химических элементов происходит
уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
Часть 2
9. Используя метод электронного
баланса, составьте уравнение реакции по схеме:
Определите окислитель и восстановитель.
10. К раствору сульфата алюминия
массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария.
Вычислите массу образовавшегося осадка.
Спецификация
Максимальный балл за работу в целом – 15.
Задания 1-8, оцениваемые одним баллом,
считаются выполненными верно, если указан номер верного ответа или записана
соответствующая последовательность цифр.
Задание 9 оценивается в 3 балла, если
верно написано уравнение реакции и расставлены коэффициенты, и определена
степень окисления.
Задание 10 оценивается в 4 балла и
считается выполненным верно, если обучающийся выбрал правильный путь решения,
из письменной записи решения понятен ход его рассуждений, получен верный ответ.
0 – 4 балла – оценка «2»
5 — 8 баллов – оценка «3»
8 – 11 баллов – оценка «4»
12 — 15 баллов – оценка «5».
Демонстрационный вариант № 1
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя
22 задания. Часть 1 содержит 19 заданий с кратким ответом, часть 2 содержит 3 задания с развёрнутым ответом.
На выполнение экзаменационной работы по химии отводится 2 часа
(120 минут).
Ответы к заданиям 1–15 записываются в виде одной цифры, которая соответствует номеру правильного ответа. Эту цифру запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
Ответы к заданиям 16–19 записываются в виде последовательности
цифр. Эту последовательность цифр запишите в поле ответа в тексте работы, а затем перенесите в бланк ответов № 1.
К заданиям 20–22 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты. Задания выполняются на бланке ответов № 2.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
При выполнении заданий можно пользоваться черновиком. Записи
в черновике, а также в тексте контрольных измерительных материалов не учитываются при оценивании работы.
Баллы, полученные Вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее
количество баллов.
Желаем успеха!__
Часть 1
Ответом к заданиям 1–15 является одна цифра, которая соответствует
номеру правильного ответа. Запишите эту цифру в поле ответа
в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от
номера соответствующего задания, начиная с первой клеточки.
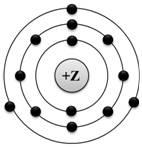
изображена модель атома химического элемента |
||||||||||||
|
||||||||||||
|
Ответ:
|
||||||||||||
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
|
Начало формы
Конец формы |
Ответ:
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
-
Химическая реакция возможна между
1)
оксидом кальция и соляной кислотой
2)
оксидом железа(III) и водой
3)
оксидом серы(VI) и кислородом
4)
оксидом углерода(IV) и медью
Ответ:
-
Кремниевая кислота реагирует с
|
1) |
оксидом серы(IV) |
|
|
2) |
нитратом калия |
|
|
3) |
гидроксидом натрия |
|
|
4) |
фосфатом магния |
Начало формы
Ответ:
-
В реакцию с каждым из растворов CuSO4 и Na2CO3 вступает
|
1) |
соляная кислота |
|
|
2) |
гидроксид натрия |
|
|
3) |
хлорид бария |
|
|
4) |
нитрат алюминия |
Ответ:
|
13. Верны ли суждения о способах разделения смесей? А. Выделить цинковые опилки из их смеси с древесными опилками можно с помощью магнита. Б. Смесь воды и бензина разделяют с помощью делительной воронки. |
||||||||||||
|
Ответ:
Конец формы
|
||||||||||||
|
Ответ:
|
||||||||||||
|
Ответ:
Ответом к заданиям 16–19 является последовательность цифр, которые
следует записать в БЛАНК ОТВЕТОВ № 1 справа от номера
соответствующего задания, начиная с первой клеточки. Ответ
записывайте без пробелов, запятых и других дополнительных символов.
Каждую цифру пишите в отдельной клеточке в соответствии с
приведёнными в бланке образцами.
При выполнении заданий 16, 17 из предложенного перечня ответов
выберите два правильных и запишите в таблицу цифры, под которыми
они указаны.
|
Начало формы
Конец формы |
Ответ
|
|||||||||||||||
|
Ответ
При выполнении заданий 18, 19 к каждому элементу первого столбца
подберите соответствующий элемент из второго столбца. Запишите
в таблицу выбранные цифры под соответствующими буквами. Цифры
в ответе могут повторяться.
|
|
|
А |
Б |
В |
Ответ
|
|
|
А |
Б |
В |
Ответ
Не забудьте перенести все ответы в бланк ответов № 1
в соответствии с инструкцией по выполнению работы.
Часть 2
Для ответов на задания 20–22 используйте БЛАНК ОТВЕТОВ № 2.
Запишите сначала номер задания (20, 21 или 22), а затем развёрнутый
ответ к нему. Ответы записывайте чётко и разборчиво.
|
-
К раствору серной кислоты с массовой долей 5% добавили избыток раствора нитрата бария. При этом выпал осадок массой 11,65г. Определите массу исходного раствора серной кислоты.
-
Даны вещества: Cu, CuO, NaCl, AgNO3, HCl (р-р), Ba(NO3)2. Используя воду
и необходимые вещества только из этого списка, получите в две стадии нитрат меди(II). Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для второй реакции напишите сокращенное ионное уравнение реакции.
Муниципальное бюджетное
общеобразовательное учреждение
города Ульяновска «Средняя школа
№ 53 имени заслуженного учителя
Российской Федерации И.В.Исакова»
Материалы для итоговой
аттестации
«Переводная контрольная работа
по химии 8 класс»
8 класса
Учитель химии
Федотова Ксения Николаевна
Источники:
1)О.С. Габриелян Учебник химии
8 класс 213 год издательство
Дрофа Москва 2013 год
2) https://chem-oge.sdamgia.ru/
Экзаменационная работа по химии
Ученика (цы) 8 ————— класса
Фамилия, имя —————————————————————————————————
———————
Вариант ————
Председатель экзаменационной комиссии ——————-——-————-/-———————
———/
Учитель ——————————————————-———————————/——————
————-/
Ассистент————————————-————————————————/-——————
————-/
Пояснительная записка
Переводная контрольная работа составлена на основе Контрольно измерительных
материалов входящих в тесты ОГЭ по химии.
Цель экзамена: выявление усвоения учащимися обязательного минимума знаний и
умений; владения основными понятиями, законами, формулами.
Темы:
1) Простые и сложные вещества.
2) Строение атома.
3) Периодический закон и Периодическая система химических элементов.
4) Степень окисления.
5) Виды химической связи.
6) Классы неорганических веществ: оксиды, основания, кислоты, соли.
7) Типы химических реакций: соединения, разложения, обмена, замещения.

9) Электролиты и неэлектролиты.
10) Химические свойства: оксидов, оснований, кислот, солей.
11) Ионные уравнения.
12) Расчет массовой доли элемента.
13) Химические свойства основных классов неорганических соединений.
Структура работы и система оценивания.
Экзаменационная работа состоит из трех частей:
Часть А включает в себя 10 заданий с выбором ответа. Верный ответ оценивается в 1
балл максимальное количество баллов за часть А – 10.
Часть В состоит из двух заданий со свободным ответом. Верный ответ оценивается в 2
балла— нет ошибок, допущена 1 ошибка—1 балл, 0 баллов— допущены 2 и более ошибок.
Максимальный балл за часть В — 4 балла.
Часть С включат в себя одно задание со свободным ответом, уровень сложности
повышенный. Верный ответ оценивается в 4 балла. Допущена 1 ошибка—3 балла, 2
ошибки—2 балла, 3 ошибки— 1 балл, более 3 ошибок— 0 баллов.
Критерии оценивания
Максимальный балл: 18
Оценка «5»— 15-18 баллов
Оценка «4»—11-14 баллов
Оценка «3»-7-10 баллов
Оценка «2»— 0-6 баллов
Вариант №1
А1) Простым является каждое из двух веществ:
1) Гидроксид натрия и кислород 3) Азотная кислота и вода
2) Водород и азот 4) Оксид алюминия и белый фосфор
А2 )Ряд чисел 2,8,7 соответствует распределению электронов по энергетическим
уровням атома
1) магния 3) хлора
2) фтора 4) серы
А3) Наиболее ярко неметаллические свойства выражены у
1) Алюминия 3) Цинка
2) Углерода 4) Меди
А4) Степень окисления серы в соединении H2SO4 равна
1) +4 3) +6
2) +3 4) +2
А5) Химическая связь в молекуле хлора CI 2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
А6) Вещества, формулы которых — Na2SO4 и Ca(OH)2, являются соответственно
1) оксидом и кислотой
2) оксидом и солью
3) основанием и кислотой
4) солью и основанием
А7) Реакции ионного обмена соответствует уравнение
1. Ba + O2 → BaO
2. Fe(OH)3 + HCl → FeCl3 + H2O
3. Na + S → Na2S
4. Fe + O2 → Fe3O4
А8) Коэффициент перед формулой водорода в уравнении реакции, схема которой
Fe
2
O
3
+ H
2
= Fe + H
2
O равен
1) 1
2) 2
3) 3
4) 4
А9) Электрический ток не проводит
1) расплав хлорида натрия
2) расплав оксида кремния
3) раствор азотной кислоты
4) раствор хлорида цинка
А10) Гидроксид меди(II) реагирует с
1) оксидом бария
2) соляной кислотой
3) хлоридом калия
4) гидроксидом натрия
В1. Запишите молекулярное, полное ионное, сокращенное уравнение между
гидроксидом бария и серной кислотой Ba(OH)2+H2SO4=
В2. Рассчитайте массовую долю каждого элемента в серной кислоте H
2
SO
4
Часть С
С1 Напишите уравнения реакций, с помощью которых можно осуществить
превращения медь ––> оксид меди(II) ––> гидроксид меди(II)
В первом уравнении расставьте коэффициенты методом электронного баланса, а для
последнего запишите полное и сокращенное ионные уравнения.
Вариант №2
А1) Сложными являются каждое из двух веществ:
1) Водород и соляная кислота 3) Кислород и озон
2) Хлорид натрия и фосфорная кислота 4) Белый фосфор и азот
А2) Ряд чисел 2,8,6 соответствует распределению электронов по энергетическим
уровням атома
1) магния 3) хлора
2) фтора 4) серы
А3) Наиболее ярко металлические свойства выражены у
1) Кремния 3) Алюминия
2) Хлора 4) Фтора
А4) Степень окисления азота в соединении HNO3 равна
1) +4 3) +5
2) +3 4) +2
А5)Химическая связь в молекуле оксида алюминия Al2O3
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
А6)Вещества, формулы которых — СО2 и NaCl, являются соответственно
1)кислотой и основанием
2) оксидом и солью
3) солью и кислотой
4) оксидом и кислотой
А7) Реакции замещения соответствует уравнение
1. C + O2 → CO2
2. CH4 → C2H2 + H2
3. Ca + HCl → CaCl2 + H2
4. K + S → K2S
А8) Коэффициент перед формулой кислорода в уравнении реакции горения пропана,
схема которой C3H8 + O2 ––> CO2 + H2O равен
1) 3
2) 5
3) 7
4) 9
А9) Электрический ток проводит
1) раствор хлороводорода
2) расплав серы
3) расплав оксида кремния
4) раствор глюкозы
А10) Гидроксид железа(II) реагирует с раствором
1) сульфата натрия
2) карбоната калия
3) хлорида кальция
4) бромоводорода
Часть В
В1. Запишите молекулярное, полное ионное , сокращенное уравнение
Между сульфатом кальция и карбонатом натрия CaSO4+Na2CO3=
В2. Рассчитайте массовую долю каждого элемента в сернистой кислоте H
2
SO
3
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения алюминий ––> оксид алюминия ––> гидроксид алюминия
В первом уравнении расставьте коэффициенты методом электронного баланса, а для
последнего запишите полное и сокращенное ионные уравнения.
Вариант №3
А1) Простым является каждое из двух веществ:
1) хлор и фтор 3) вода и натрий
2) углекислый газ и азот 4) серная кислота и бром
А2)Ряд чисел 2,8,2 соответствует распределению электронов по энергетическим
уровням атома
1) магния 3) хлора
2) фтора 4) серы
А3) Наиболее ярко неметаллические свойства выражены у
1) Хлора 3) Натрия
2) Калия 4) Стронция
А4) Степень окисления серы в соединении H2SO3 равна
1) +4 3) +6
2) +3 4) +2
А5)Химическая связь в молекуле водорода H2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
А6) Вещества, формулы которых —ZnO и Na2SO4, являются соответственно
1) оксидом и солью
2) оксидом и основанием
3) кислотой и основанием
4) основанием и солью
А7) Реакции разложения соответствует уравнение
1) HNO3 + CaO → Ca(NO3)2 + H2O
2) CH4 → C2H2 + H2
3) BaO + H2SO4 → BaSO4 + H2O
4) Fe + Cl2 → FeCl3
А8) Коэффициент перед формулой кислорода в уравнении реакции, схема которой
С2Н2 + О2 ––> СО2 + Н2О, равен
1) 2
2) 3
3) 4
4) 5
А9) Электрический ток не проводит
1) раствор бромоводорода
2) расплав карбоната натрия
3) раствор этилового спирта
4) расплав хлорида калия
А10) Гидроксид кальция реагирует с
1) углекислым газом
2) кислородом
3) водородом
4) хлоридом натрия
В1. Запишите молекулярное, полное ионное, сокращенное уравнение
Между гидроксидом натрия и сульфатом железа NaOH+FeSO4=
В2. Рассчитайте массовую каждого элемента в азотной кислоте HNO3
Часть С
С1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения литий –– ––> гидроксид лития ––> хлорид лития
В первом уравнении расставьте коэффициенты методом электронного баланса, а для
последнего запишите полное и сокращенное ионные уравнения.
Вариант №4
А1)Сложными являются каждое из двух веществ:
1) Калий и углекислый газ 3) Фосфат калия и оксид меди
2) Йод и азотная кислота 4) Цинк и вода
А2)Ряд чисел 2,8,3 соответствует распределению электронов по энергетическим
уровням атома
1) магния 3) хлора
2) алюминия 4) серы
А3)Наиболее ярко металлические свойства выражены у
1) Кремния 3) Натрия
2) Хлора 4) Фтора
А4) Степень окисления азота в соединении HNO2 равна
1) +4 3) +5
2) +3 4) +2
А5)Химическая связь в молекуле бромида калия KBr
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
А 6) Вещества, формулы которых —MgO и Na2SO3, являются соответственно
1) оксидом и солью
2) оксидом и основанием
3) кислотой и основанием
4) основанием и солью
А7) Реакции соединения соответствует уравнение
1) HNO3 + CaO → Ca(NO3)2 + H2O
2) CH4 → C2H2 + H2
3) Ca + HCl → CaCl2 + H2
4) K + S → K2S
А8) Коэффициент перед формулой углекислого газа в уравнении реакции горения
этана, схема которой C
2
H
6
+ O
2
––> CO
2
+ H
2
O
1) 2
2) 3
3) 4
4) 5
А9) К электролитам не относится
1) cульфат меди(II)
2) серная кислота
3) гидроксид калия
4) оксид углерода(II)
А10) В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
В1. Запишите молекулярное, полное ионное , сокращенное уравнение между
Хлоридом серебра и фосфорной кислотой AgCl+H3PO4=
В2. Рассчитайте массовую каждого элемента в азотистой кислоте HNO2
Часть С
С1. Напишите уравнения реакций, с помощью которых можно осуществить
превращения кальций ––> оксид кальция ––> хлорид кальция. В первом уравнении
расставьте коэффициенты методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21 марта 2021
В закладки
Обсудить
Жалоба
Итоговые тесты за курс 8 класса могут быть использованы в качестве переводного экзамена по химии.
Экзамен по химии в 8-ом классе — это годовой итог работы учителя и учащихся. Тесты предназначены для определения уровня усвоения основных понятий курса: первоначальные химические понятия; атомы химических элементов; простые вещества; основные классы неорганических соединений; изменения, происходящие с веществами; растворы; реакции ионного обмена и окислительно-восстановительные реакции.
it8h.docx
it8h.pdf
В нашей школе с углубленным изучением
предметов естественно-математического цикла
изучение химии начинается в 7 классе с
пропедевтического курса Габриеляна О.С.
«Введение в химию». Школьники, изучающие химию
углубленно, после 8 класса сдают письменный
переводной экзамен. Время проведения работы – 90
минут. Учащиеся могут использовать калькулятор и
справочные таблицы (периодическую систему
химических элементов Д.И.Менделеева, таблицу
растворимости и электрохимический ряд
напряжений металлов). Задания тестовой части
оцениваются 22 баллами (с № 1- №16 оцениваются по 1
баллу, с №17- № 19 по 2 балла). Задания со свободным
ответом оцениваются 15 баллами (№ 20 – 11 баллов, №
21 – 4 балла). Критерии отметки: «2» – до 13 баллов
(до 34% выполнения работы), «3» – 14-20 баллов (35%-54%
выполнения работы), «4» – 21-29 баллов (55%-79%), «5» –
30-37 баллов (80%-100% выполнения работы).
Экзаменационная работа по химии за 8
класс
Вариант 1
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) гранит
2) фосфор
3) известняк
4) вода
2. Ряд чисел 2,8,5 соответствует распределению
электронов по энергетическим уровням атома
1) алюминия
2) азота
3) фосфора
4) хлора
3. Наиболее ярко неметаллические свойства
выражены у
1) Sn
2) Ge
3) Si
4) С
4. Степень окисления хрома в оксиде CrO3
равна
1) + 2
2) – 4
3) + 3
4) + 6
5. Химическая связь в молекуле брома Br2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы оксида, основания, соли
соответственно
1) BaO, Fe(OH)2, NaNO3
2) SiO2, CaO, K2CO3
3) P2O5, Na2O, CaCl2
4) SO3, P2O5, KOH
7. Уравнение реакции замещения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой углекислого газа
в уравнении реакции горения этана, схема которой
C2H6 + O2 ––> CO2 + H2O
1) 2
2) 3
3) 4
4) 5
9. Соль и водород образуются при взаимодействии
соляной кислоты с
1) металлами (не всеми)
2) основаниями
3) основными оксидами
4) кислотными оксидами
10. Гидроксид меди(II) реагирует c
1) H2O
2) HNO3
3) Al2O3
4) Au
11.Оксид кальция реагирует с
1) Li2O
2) Cu
3) HNO3
4) MgO
12. Формула вещества X в схеме превращений FeO
––> X ––> FeCl2
1) Fe2O3
2) FeCl3
3) Fe
4) Fe(OH)3
13. Фенолфталеин изменяет окраску при
добавлении к
1) H2SO4 (р-р)
2) NaOH (р-р )
3) H2O
4) Cu(OH)2
14. К электролитам относится каждое из веществ в
ряду
1) Na2O, KOH, Na2CO3
2) CuCl2, HCl, Na2SO4
3) Ba(OH)2, NH3, H2SiO3
4) CaCl2, Fe(OH)3, CO
15. К реакциям ионного обмена относится
1) 2NaOH + CO2 = Na2CO3 + H2O
2) CuO + H2SO4 = CuSO4 + H2O
3) NaCl + AgNO3 = NaNO3 + AgCl
4) 2HNO3 + Na2O = 2NaNO3 + H2O
16. В соответствии с сокращенным ионным
уравнением Cu2+ + 2OH– = Cu(OH)2
взаимодействуют электролиты
1) CuSO4 и Fe(OH)2
2) CuC2 и KOH
3) CuO и KOH
4) Cu2S и KOH
17. Массовая доля кислорода в серной кислоте H2SO4
равна приблизительно
1) 16%
2) 33%
3) 65%
4) 2%
18. Количество водорода, выделившегося при
взаимодействии 325 г цинка с соляной кислотой,
равно
1) 1 моль
2) 3 моль
3) 5 моль
4) 7 моль
19. Для приготовления 5%-ного раствора необходимо
2 г сахара растворить в воде, массой
1) 19 г
2) 20 г
3) 38 г
4) 40 г
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения кальций
––> оксид кальция ––> X ––> хлорид кальция.
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 18%-ного раствора гидроксида
бария с серной кислотой.
Вариант 2
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) хлороводород
2) иод
3) метан
4) поваренная соль
2. Ряд чисел 2,6 соответствует распределению
электронов по энергетическим уровням атома
1) серы
2) углерода
3) кремния
4) кислорода
3. С увеличением заряда ядер атомов в ряду F
––> Cl ––> Br ––> I неметаллические свойства
1) усиливаются
2) ослабевают
3) не изменяются
4) изменяются периодически
4. Степень окисления +6 сера имеет в веществе
1) SO2
2) H2S
3) H2SO3
4) H2SO4
5. Ионную кристаллическую решетку имеет
1) оксид натрия
2) вода
3) алюминий
4) алмаз
6. Формулы растворимого основания, соли ,
кислоты , соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ca(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ba(OH)2, NaNO3, HNO3
7. Уравнение реакции обмена
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой водорода в
уравнении реакции, схема которой Fe2O3 +
H2 = Fe + H2O равен
1) 1
2) 2
3) 3
4) 4
9. Формулы продуктов реакции алюминия с соляной
кислотой и коэффициенты перед ними в
соответствующем уравнении реакции
1) AlCl3 и 3H2
2) AlCl3 и H2
3) 2AlCl3 и 2H2
4) 2AlCl3 и 3H2
10. Основания могут реагировать
1) только с кислотами
2) с кислотами и основными оксидами
3) только с основными оксидами
4) с кислотами и кислотными оксидами
11. Оксид серы (IV) не реагирует с
1) NaOH
2) CaO
3) H2O
4) CO2
12. Формула вещества X в схеме превращений C ––>
СO2 ––> X
1) СO
2) CH4
3) C
4) H2CO3
13. Метилоранж изменяет окраску при добавлении к
1) соляной кислоте
2) гидроксиду железа (III)
3) воде
4) гидроксиду меди (II)
14. Сульфат-ионы образуются при диссоциации
1) сульфида натрия
2) сернистой кислоты
3) серной кислоты
4) сульфата бария
15. К реакциям ионного обмена относится реакция
1) Ca + 2H2O = Ca(OH)2 + H2
2) Na2CO3 + 2HNO3 = 2NaNO3 + CO2 +
H2O
3) Zn + H2SO4 = ZnSO4 + H2
4) 3H2O + P2O5 = 2 H3PO4
16. Соли, при взаимодействии которых с
растворами, содержащими ионы Ag+, образуется
осадок белого цвета, называются
1) нитратами
2) фторидами
3) хлоридами
4) сульфитами
17. Массовая доля серы в оксиде серы(VI) SO3
равна
1) 40%
2) 60%
3) 20%
4) 10%
18. Масса серы, необходимой для получения 4 моль
оксида серы(IV), равна
1) 32 г
2) 64 г
3) 128 г
4) 16 г
19. Массовая доля растворенного вещества в
растворе, приготовленном из 120 г воды и 40 г соли,
равна
1) 20%
2) 25%
3) 30%
4) 35%
Запишите полностью ход решения
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения медь
––> оксид меди(II) ––> X ––> гидроксид меди(II)
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу соли, образовавшейся при
взаимодействии азотной кислоты и 50 г 12%-ного
раствора гидроксида натрия.
Вариант 3
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) серная кислота
2) спирт
3) оксид калия
4) кислород
2. Четыре электрона на внешнем электронном
уровне имеет атом
1) гелия
2) бериллия
3) углерода
4) кислорода
3. Наиболее ярко выражены металлические
свойства у
1) Li
2) C
3) N
4) O
4.Степень окисления + 6 хром имеет в веществе
1) Cr
2) CrO
3) CrCl3
4) H2CrO4
5.Формула вещества с ковалентной неполярной
связью
1) SO3
2) Br2
3) H2O
4) NaCl
6. Формулы нерастворимого основания, соли,
кислоты, соответственно
1) Zn(OH)2, CaCl2, HCl
2) BaO, Ba(OH)2, H2SO4
3) Mn2O7, CaO, ZnO
4) Ca(OH)2, NaNO3, HNO3
7. Уравнение реакции разложения
1) Zn + 2HCl = ZnCl2 + H2
2) ZnO + H2SO4 = ZnSO4 + H2O
3) Cu(OH)2 = CuO + H2O
4) Fe + S = FeS
8. Коэффициент перед формулой кислорода в
уравнении реакции горения пропана, схема которой
C3H8 + O2 ––> CO2 + H2O
равен
1) 3
2) 5
3) 7
4) 9
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции гидроксида натрия
с серной кислотой
1) Na2SO4 и H2
2) Na2SO4 и H2O
3) Na2SO4 и 2H2O
4) Na2SO3 и H2
10. Гидроксид калия не взаимодействует с
1) соляной кислотой
2) оксидом железа(II)
3) оксидом серы (VI)
4) азотной кислотой
11. Оксид серы (IV) реагирует с
1) кислотами
2) щелочами
3) кислотными оксидами
4) сульфатом натрия
12. Формула вещества X в схеме превращений C ––>
CO2 ––> X
1) СО
2) СН4
3) Н2СО3
4) С
13. В растворе кислот
1) метилоранж желтеет
2) лакмус синеет
3) лакмус краснеет
4) фенолфталеин становится малиновым
14. Гидроксид-ионы образуются в процессе
диссоциации
1) хлорида калия
2) гидроксида железа(III)
3) хлороводорода
4) гидроксида лития
15. Реакции ионного обмена соответствует
уравнение
1) 2H2S + 3O2 = 2SO2 + 2H2O
2) CaCO3 = CaO + CO2
3) Zn + H2SO4 = ZnSO4 + H2
4) 2KOH + H2SO4 = K2SO4 + 2H2O
16. В растворе одновременно не могут содержаться
ионы
1) Ba2+ и SO42–
2) Na+ и SO42–
3) Ba2+ и OH–
4) Ag+ и NO3–
17. Массовая доля кислорода в оксиде углерода(IV)
СО2 равна приблизительно
1) 73%
2) 50%
3) 30%
4) 20%
18. Масса фосфора необходимого для получения 0,1
моль оксида фосфора(V) – Р2О5
1) 31 г
2) 3,1 г
3) 6,2 г
4) 0,2 г
19. При растворении 10 г щелочи в 30 г воды
получается раствор с массовой долей щелочи
1) 5%
2) 10%
3) 20%
4) 25%
Запишите полный ответ
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения алюминий
––> оксид алюминия ––> X ––> гидроксид
алюминия
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. К 50 г 20%-ного раствора силиката натрия
добавили азотной кислоты. Рассчитайте массу
образовавшегося осадка.
Вариант 4
Выберите один правильный ответ. Номер
правильного ответа запишите в карту ответов.
1. К простым веществам относится
1) бром
2) углекислый газ
3) азотная кислота
4) гранит
2. Распределению электронов по энергетическим
уровням атома хлора соответствует ряд чисел
1) 2, 8, 7
2) 2, 7
3) 2. 8, 5
4) 2, 5
3. Наиболее выражены металлические свойства у
1) кремния
2) алюминия
3) натрия
4) магния
4. Степень окисления +5 азот проявляет в
соединении
1) NO
2) N2O3
3) NO2
4) N2O5
5. Химическая связь в молекуле аммиака NH3
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
6. Формулы нерастворимого основания, соли,
кислоты соответственно
1) Cu(OH)2, NaCl, H2SO4
2) Ba(OH)2, BaCl2, HNO3
3) Mg(OH)2, H2, Ca(NO3)2
4) NaOH, Na2SO4, H2SO4
7. Взаимодействие соляной кислоты с оксидом
магния относится к реакции
1) разложения
2) соединения
3) замещения
4) обмена
8. Коэффициент перед формулой кислорода в
уравнении реакции, схема которой С2Н2
+ О2 ––> СО2 + Н2О, равен
1) 2
2) 3
3) 4
4) 5
9. Формулы продуктов реакции и коэффициенты
перед ними в уравнении реакции азотной кислоты с
гидроксидом меди (II)
1) Cu(NO3)2 и 2H2O
2) Cu(NO3)2 и H2
3) CuO и 2H2O
4) CuO и H2O
10. Гидроксид кальция реагирует с
1) HCl
2) Fe(OH)2
3) MgO
4) Ag
11. Большинство кислотных оксидов реагирует
1) только с водой
2) только с кислотами
3) со щелочами и кислотами
4) с водой и щелочами
12. Формула вещества Х в схеме превращений Сu
––> X ––> CuCl2
1) CuO
2) Cu(OH)2
3) Cu2O
4) CuOH
13. Лакмусом можно распознать
1) соляную кислоту
2) гидроксид железа(III)
3) воду
4) оксид кремния (IV)
14. Ионы металла и гидроксогрупп при
электролитической диссоциации образует
1) гидроксид меди(II)
2) азотная кислота
3) гидроксид калия
4) нитрат кальция
15. Сокращенное ионное уравнение Сu2+ + 2OH–
= Cu(OH)2 cоответствует реакции между
1) CuCl2 и AgNO3
2) Cu(OH)2 и H2SO4
3) CuSO4 и Ba(NO3)2
4) Cu(NO3)2 и Ca(OH)2
16. В растворе одновременно не могут содержаться
ионы
1) Ag+ и NO3–
2) Ag+ и Cl–
3) Ba2+ и OH–
4) K+ и SO42–
17. Массовая доля углерода в карбонате кальция
СаСО3 равна
1) 12%
2) 40%
3) 48%
4) 100%
18. Масса цинка, расходуемого для получения 6
моль водорода, при взаимодействии с соляной
кислотой
1) 65 г
2) 130 г
3) 260 г
4) 390 г
19. Для приготовления 400 г 2%-ного раствора соли
необходима масса соли
1) 2 г
2) 4 г
3) 8 г
4) 10 г
Запишите полный ответ.
20. Напишите уравнения реакций, с помощью
которых можно осуществить превращения литий
––> Х ––> гидроксид лития ––> хлорид лития
В первом уравнении расставьте коэффициенты
методом электронного баланса, а для последнего
запишите полное и сокращенное ионные уравнения.
21. Определите массу осадка, образовавшегося при
взаимодействии 50 г 20%-ного раствора серной
кислоты с хлоридом бария.
Тесты к переводному экзамену по химии в 8 классе
Вариант 1
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома алюминия равен
1) +2;
2) +13;
3) +12;
4) +20; А 2 В ряду Ca(OH)2 → AI(OH)3→ H2SO4свойства гидроксидов изменяются от
1) амфотерных к основным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в оксиде фосфора (Y)
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность азота в соединениях NO2 и N2O5 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и Y
А 5. К амфотерным оксидам относится вещество, формула которого
1) Mg(OH)2
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между магнием и серной кислотой коэффициент перед формулой
серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции обмена
1) Mg O+HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Алюминий реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом калия
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, H2О — с гидроксидом алюминия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом калия
А 11. Раствор гидроксида натрия реагирует с
1) оксидом серы(IY)
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na2SO3 окисления серы
1) +4;
2) +6;
3) +2;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) В;
3) Ga;
4) Sr;
А 15. Вещество H3PO4-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (I)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (O2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 8.1 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO элемент Э – это
1) K
2) AI
3) H
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СO2
2) Li2O и H2O
3) CaO и NO2
47) SO3 и CuO
А 24. В уравнении реакции между оксидом железа (III) и серной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома фосфора
1) 12
2) 4
3) 5
4) 1
А 26. В формуле сульфата алюминия индексы при символе алюминия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Магний реагирует с
1) серной кислотой
2) медью
3) сульфатом натрия
4) оксидом углерода(IY)
А 28Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30 Соли калия, имеющие формулы K3PO4, KNO3 , KCI, называются
1) нитрит, хлорид, фосфид
2) нитрат, хлорат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и H2SO4
2) CaO и NaOH
3) CuO и MgO
4) SO2 и H2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид калия
-
оксид углероды (IY)
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид фосфора (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ:_____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Na→Na2O→X→Na3PO4
C 2. Какая масса нитрата магния образуется при взаимодействии оксида магния и 196 г азотной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 2
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома калия равен
1) +19;
2) +13;
3) +12;
4) +20; А 2 В ряду AI(OH) →3 Ca(OH)2 → H2SO4свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к;
А 3. Химическая связь в оксиде магния
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях СO2 и Na2CО3соответственно равно
1) I и II
2) II и I
3) IYи IY
4) IY и II
А 5. К солям относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между гидроксидом магния и фосфорной кислотой коэффициент перед формулой фосфорной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции разложения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) соляной кислотой
3) цинком
4) хлоридом ртути
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, K2O, H2O— с оксидом серы(YI)
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) оксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) гидроксидом магния
2) водой
3) оксидом серы(YI)
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении К3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наименьший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg3(PO4)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль кислорода (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, 2 имеет атом
1) Mg
2) S
3) Ca
4) К
А 19. 24,5г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 5
А 20. Запись 2 H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная полярная связь осуществляется в веществе
1) H2SO4
2) Р
3) SО2
4) NaBr
А 22. В веществе состава ЭO3 элемент Э – это
1) K
2) AI
3) S
4) Ca
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и азотной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома кремния
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата калия индексы при символе калия и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 1
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28. Массовая кислорода в воде равна
1) 88,88
2) 10,5%
3) 33,2%
4) 44,1%
А 29. Соли калия, имеющие формулы K2SO4, KNO3,3PO4 называются
1) нитрит, хлорид, фосфид
2) сульфат, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
А 30. Число электронных слоёв в атоме равно
1) номеру группы
2) порядковому номеру
3) номеру периода
4) 8- номер группы
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и K2O
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Mg→ Х→ Mg(OH)→MgO
C 2. Какая масса сульфата алюминия образуется при взаимодействии гидроксида алюминия и
24,5 г серной кислоты.
Тесты к переводному экзамену по химии в 8 классе.
Вариант 3
К каждому из заданий А1-А30 даны 4 варианта ответа, из которых только один правильный
Часть. А
А 1 Заряд ядра атома хлора равен
1) +19;
2) +13;
3) +17;
4) +20; А 2 В ряду NaOH → Zn(OH)2 → H2SO3свойства гидроксидов изменяются от
1) амфотерных к кислотным;
2) кислотных к основным;
3) кислотных к амфотерных;
4) основных к кислотным;
А 3. Химическая связь в азотной кислоте
1) ионная;
2) металлическая;
3) ковалентная неполярная;
4) ковалентная полярная
А 4 Валентность углерода в соединениях SO2 и SO3 соответственно равно
1) I и II
2) II и I
3) YIи II
4) IY и YI
А 5. К кислотным оксидам относится вещество, формула которого
1) SO3
2) MgSO4
3) HNO3
4) Fe2O3
А 6. В уравнении реакции между оксидом магния и серной кислотой коэффициент перед
формулой серной кислоты равен
1) 1 3) 2
2) 3 4) 4
А 7. Какое из указанных уравнений соответствует реакции замещения
1) MgO +2HCI=MgCI2+H2O
2) S+O2=SO2
3) 2AgNO3+Mg=2Ag+Mg (NO3)2
4) 2 Fe (OH) 3=Fe2O3+3H2O
А 8. Медь реагирует с
1) оксидом магния
2) гидроксидом калия
3) цинком
4) хлоридом серебра
А 9. Из приведённого перечня веществ: H2SO4, NaOH, CO2, CuО — с гидроксидом натрия
реагирует
1) два
2) одно
3) три
4) четыре
А 10. Раствор серной кислоты реагирует с
1) оксидом углерода (IY)
2) гидроксидом кальция
3) серой
4) хлоридом натрия
А 11. Раствор гидроксида кальция реагирует с
1) азотной кислотой
2) водой
3) оксидом кальция
4) медью
А 12. Верны ли следующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в результате реакции соединения.
Б При физических явлениях изменяется агрегатное состояние и форма
1) верно только. А
2) верно только. Б
3) верны оба суждения
4) оба суждения не верны
А 13. В соединении Na3PO4 окисления фосфора
1) +4;
2) +6;
3) +5;
4) +1;
А 14. Наибольший радиус у атома
1) AI;
2) Mg;
3) P;
4) Si;
А 15. Вещество Mg(OH)2-это
1) соль;
2) кислота;
3) основание;
4) оксид;
А 16. Формула хлорида меди (II)-это
1) CuCI;
2) CuСI2;
3) СuCIO;
4) СuCIO3;
А 17. 2 моль азота (N2) занимают объём … л (н.у)
1) 67,2
2) 22,4
3) 44,8
4) 64
А 18. Распределение электронов по слоям 2, 8, имеет атом
1) Ne
2) S
3) Ca
4) К
А 19. 196 г фосфорной кислоты составляют … моль
1) 1
2) 0,25
3) 0,5
4) 2
А 20. Запись H2 означает
1) молекулу водорода
2) две молекулы водорода
3) два атома водорода
4) молекулу воды
А 21. Ковалентная неполярная связь осуществляется в веществе
1) H2SO4
2) O2
3) SО2
4) NaBr
А 22. В веществе состава ЭO2 элемент Э – это
1) K
2) AI
3) S
4) C
А 23. Кислотные оксиды – это
1) P2O5 и СaO
2) Li2O и H2O
3) CaO и NO2
4) SO3 и P2O5
А 24. В уравнении реакции между оксидом железа (II) и соляной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
1) 1: 3
2) 1: 2
3) 2: 3
4) 1:1
А 25. Число электронов во внешнем электронном слое атома натрия
1) 12
2) 4
3) 5
4) 1
А 26. В формуле фосфата магния индексы при символе магния и кислотном остатке равны соответственно
1) 1 и 2
2) 2 и 3
3) 1 и 3
4) 3 и 2
А 27.Ртуть реагирует с
1) серной кислотой
2) медью
3) хлоридом серебра
4) оксидом углерода(IY)
А 28 Ядро состоит из
1) протонов, нейтронов и электронов
2) протонов и электронов
3) нейтронов и электронов
4) протонов и нейтронов
А 29. Массовая кислорода в воде равна
1) 10,5%
2) 88,88
3) 33,2%
4) 44,1%
А 30. Соли калия, имеющие формулы KCI, KNO3, К3PO4 называются
1) нитрит, хлорид, фосфид
2) хлорид, нитрат, фосфат
3) нитрид, хлорат, фосфид
4) фосфат, нитрат, хлорид,
Часть. Б
При выполнении заданий В1 и В4 из предложенного перечня ответов выберите два правильных и обведите их номера. Цифры выбранных ответов запишите в указанном месте без дополнительных символов
В 1. В ряду химических элементов N—P—As
1) уменьшаются радиусы атомов
2) увеличиваются радиусы атомов
3) увеличиваются число электронов на внешнем электронном слое
4) увеличиваются число электронных слоёв
5) увеличивается электроотрицательность
Ответ:__________________
B 2. Химические реакции возможны между
1) K2O и MgO
2) CaO и H2SO4
3) Cu(OH)2 и MgO
4) SO2 и Mg
5) Cu и H2S
Ответ: ___________________
В 3.В реакцию с раствором соляной кислоты вступают
-
медь
-
алюминий
-
оксид углероды (IY)
-
оксид магния
-
сульфат натрия
Ответ: ___________________
В 4. С раствором гидроксида натрия реагируют
1) азотная кислота
2) оксид азота (Y)
3) гидроксид магния
4) углерод
5) оксид меди ( II)
Ответ: _____________________
Часть. С
С 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P→P2O5 →X→Na3PO4
C 2. Какая масса нитрата алюминия образуется при взаимодействии гидроксида алюминия и
32,5 г азотной кислоты.