Конспекты по предмету «ХИМИЯ»
Изучение Химии шаг за шагом. Онлайн-учебник и сборник задач.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Конспекты по кодификатору ОГЭ
Конспекты по кодификатору ЕГЭ
Химия 8 класс
Первоначальные химические понятия. Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
- Вещества и их свойства. Чистые вещества и смеси
- Физические и химические явления
- Атомы, молекулы и ионы
- Простые и сложные вещества
- Химические элементы и их знаки
- Относительная атомная масса
- Закон постоянства состава веществ
- Химическая формула. Индекс. Коэффициент
- Массовая доля элемента в соединении
- Химия 8 класс Все формулы и определения
- Оксиды (названия, классификация, получение)
- Свойства оксидов
- Основания (названия, получение, свойства)
- Строение атома. Массовое число
- Строение электронных оболочек атомов
- Периодическая система химических элементов
- Закономерности изменения свойств элементов
- Строение веществ. Электроотрицательность
- Химическая связь: ковалентная, ионная, металлическая
- Валентность химических элементов
- Определение валентности + примеры
- Кислород: характеристика, свойства, получение
- Кислоты: классификация, свойства, получение
- Соли: классификация, свойства, получение
- Амфотерные оксиды и гидроксиды
- Водород: характеристика, получение
- Химические свойства водорода. Применение
- Вода. Свойства воды. Водные растворы
Химия 8 класс. Контрольные (УМК Габриелян)
Проверить знания за 8 класс (онлайн-тесты)
Химия 9 класс
Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. Общие свойства металлов. Металлы IA—IIIA-групп периодической таблицы химических элементов. Железо. Металлургия. Краткий обзор важнейших органических веществ (Углеводороды, производные углеводородов).
Химия 9 класс. Контрольные (УМК Рудзитис)
Справочники для ОГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Основному Государственному Экзамену по химии.
Химия 10 класс
Химия 10 класс. Контрольные (УМК Габриелян)
Химия 11 класс
Справочники для ЕГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Единому Государственному Экзамену по химии.
Решения задач по химии
Конспекты по кодификатору ОГЭ
Конспекты по кодификатору ЕГЭ
Источники идей и источники цитат для конспектов по Химии:
- Учебник по химии для 8 класса / Г. Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
- Учебник по химии для 9 класса / Г. Е. Рудзитис, Ф. Г. Фельдман. — М. : Просвещение.
- Ковалевская Н.Б. ХИМИЯ в таблицах и схемах. 8 класс. Для самостоятельной работы в школе и дома — М.: «Издат-Школа XXI век», 2004.
- ОГЭ. Универсальный справочник по химии / Е.Ю. Шапаренко. — Москва : Эксмо.
- Задачи по химии и способы их решения. 8—9 кл. / О. С. Габриелян, П. В. Решетов, И. Г. Остроумов. — М.: Дрофа.
- Сборник задач и упражнений по химии: Школьный курс / В. В. Еремин, Н. Е. Кузьменко. — М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство «Мир и Образование», 2005
- Справочник по химии: 8-9 классы. ФГОС / А.Д. Микитюк — М.: Издательство «Экзамен», 2019
- ЕГЭ. Химия: алгоритмы выполнения типовых заданий / Е.В. Крышилович, В.А. Мостовых — М.: Эксмо, 2018
- Химия. Самоучитель. Книга для тех, кто хочет сдать экзамены, а также понять и полюбить химию / Е. Н. Френкель. — Москва : Издательство АСТ, 2017
(с) Цитаты из вышеуказанных учебных пособий использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ).
ОПОРНЫЕ КОНСПЕКТЫ К УРОКАМ ХИМИИ
Химические терминологии
1)Орбиталь – эта та область пространства вокруг ядра, в которой вероят-
ность пребывания электрона составляет не менее 90%.
2)Гибридизация – выравнивание облаков.
3)Валентность – свойство атомов присоединять или замещать определенное
количество элементов.
4)Атом – наименьшая частица химического элемента, входящая в состав мо-
лекул простых и сложных веществ.
5)Молекула – наименьшая частица вещества, способная к самостоятельному
существованию и обладающая химическими свойствами данного вещества.
6)Химическая формула – показывает, из каких элементов состоит данное
вещество и сколько атомов каждого вещества входит в состав его молекул.
7)Ион – заряженная частица.

9)Анион – отрицательно заряженный ион.
10)Степень окисления – количество принятых или отданных электронов.
11)Окисление – отсоединение электронов.
12)Восстановление – присоединение электронов.
13)Электроотрицательность – способность атомов в соединении притягивать к себе электроны.
14)Галогены – элементы VII A группы.
15)Инертные газы – элементы VIII A группы.
16)Халькогены – элементы VI A группы (кроме кислорода).
17)Щелочные металлы – элементы I A группы.
18)Катализатор – вещество, ускоряющее реакцию, но сами при этом не рас-
ходуются.
19)Индикатор – вещество, с помощью которого определяют реакцию рас-
твора.
Неметаллы
Карбиды
Be2C + 4H2O = 2Be (OH)2 + CH4
Al4C3 + 12H2O = 4Al (OH)3 + 3CH4
MeC2 + 2H2O = Me (OH)2 + C2H2
—H 2 (Pt, t, p)→ CH 4
—O 2 t →CO 2
—Me t→ карбиды
C —S t →CS 2
—Si t →SiC
—H 2O t→ H 2 + CO
—оксиды →Э + CO
Получение
1) из воздуха
2) 4NH3 + 3O2 = 2N2 + 6H2O
3) NH4NO2 = N2 + 2H2O
—H 2t (P,t)→ NH 3
N2 —O2 2000 C→ NO
—Me t→ нитриды
—Si t→ Si 3N4
—O 2 t →N2 + H2O
—O2 (p ,t )→ NO + H2O
NH3 → —H2O→ NH4OH
—HCl→ NH4Cl
—Cl2→ N2 + HCL
—CuO t →Cu + H2O
—O2t→ SO2
—H2t→ H2S
S→ —Me t→ сульфиды
—KOH →K2S +K2SO3
—K2SO3→K2S2O3
—H2(h v)→ HCl
—Me t→ хлориды
—P→ PCl3, PCl5
Cl2 → — NH3 t→ N2 + HCl
—H2O →HCl + HClO
—KOH→ KCl + KClO
—KOH 70 C→ KCl + KClO3
—CH4 (h v)→ CH3Cl…
—C2H4→ C2H4Cl2
—C2H2→ C2H2Cl4
Металлы
I Щелочные металлы
—H2 t→ MeH
—Cl2 t→ MeCl
—N2 t→ Me3N (Li3N на воздухе)
Me→ —S t→ Me2S
O2 t→ Li2O Na2O2 K2O
—P t→ Me3P
—C t→ Me2C2
—H2O→ MeOH + H2
—HNO3 разб MeNO3 + NH4NO3 + H2O
—HNO3 конц MeNO3 + N2O + H2O
—H2SO4 конц Me2SO4 + H2S + H2O
—СОЛИ (расп) Me An + Me1
—2 R-Hal t R-R + MeHal
—R-OH R-OMe + H2
—HCl MeCl + H2
АЛЮМИНИЙ
—H2→ НЕ РЕАГИРУЕТ
—Cl2→ AlCl3
—S→ Al2S3
—N2→ ALN
—C→ Al4Cl3
—H2O→ Al(OH)3 + H2
Аl→ —NaOH→ NaAL(OH)4 + H2
—Fe2O3→ Fe + Al2O3
—HCl →AlCL3
—H2SO4 конц→ НЕ РЕАГИРУЕТ
ЦИНК
—H2O t→ ZnO + H2
—HCl→ ZnCl2
—HNO3 конц→ Zn(NO3)2 + N2O + H2O
Zn→ —HNO3 разб→ Zn(NO3)2 + NH4NO3 + H2O
—H2SO4 разб→ ZnSO4 + H2
—H2SO4 конц →ZnSO4 + H2S + H2O
—CuSO4→ ZnSO4 + Cu
—O2 t→ ZnO
—S t→ ZnS
—Cl2 →ZnCl2
—NaOH + H2O →Na2[Zn(OH)4] + H2
—HCl→ ZnCl2
Zn(OH)2→ —KOH→ K2[Zn(OH)4]
ЖЕЛЕЗО
—O2 t→ Fe3O4 (FeO + Fe2O3)
—Cl2; Br2; I2→ FeCl3; FeBr3; FeI2
—S t→ Близок к FeS
—HCl→ FeCl2 + H2
Fe→ —H2SO4 разб→ FeSO4 + H2
—H2SO4 конц →НЕ РЕАГИРУЕТ
—HNO3 конц →НЕ РЕАГИРУЕТ
—HNO3 разб→ Fe(NO)3 + NH4NO3
—СОЛИ→ Me + соль Fe
—H An СОЛИ→ Fe 3+
Fe2O3→ —NaOH t→ NaFeO2
—Na2CO3 t→ NaFeO3 + CO2
МЕДЬ
—O2 500 C→ CuO
—O2 1100 C→ Cu2O
—S t →Cu2S; CuS
—Cl2 t→ CuCl2
—HCl конц→ H[CuCl2]
Cu —HNO3 разб→ Cu(NO3)2 + NO + H2O
—HNO3 конц→ Cu(NO3)2 + NO2 + H2O
—H2SO4 конц→ CuSO4 + SO2 + H2O
—HCl + O2→ CuCl2 + H2O
—Fe2(SO4)3→ CuSO4 + FeSO4
—NaOH сплав →Na2CuO2
CuO→ —KOH p-p→ K2[Cu(OH)4]
—HCl→ CuCl2
—1100 C→ Cu2O + O2
—H2 300 C→ Cu + H2O
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
1) Написать схему уравнения . 2) Определить степени окисления элемен-
тов. 3) Найти элементы изменяющие степень окисления. 4) Составить
электронный баланс . 5) Определить коэффициенты при окислителе и
восстановителе . 6 ) Согласно закону сохранения массы веществ расста-
вить коэффициенты в уравнении . 7) Проверить правильность расстав-
ленных коэффициентов по кислородному и водородному балансу. .
О т д а ч а э л е к т р о н о в (о к и с л е н и е)
П р и с о е д и н е н и е э л е к т р о н о в (в о с с т а н о в л е н и е)
-7 6 5 4 3 2 1 0 1 2 3 4 5 6 7 +
Движение электронов
количество отданных или принятых электронов
+1 +5 —2
[ KNO3] 0
+1 X —6
+1 + X + 3−−2 = 0; 1 + X —6 = 0; X = +5
Степень окисления —
H2S + Br2 → S + 2HBr
H2S + Ag + O2 → Ag2S + H2O
MnO2 + HCl → MnCl2 + Cl2 + H2O
KMgO4 + HC→ KCl + MgCl2 + Cl2 + H2O
KClO3 + HCl → KCl + Cl2 + H2O
HNO3 (разб) + P + H2O → H3PO4 + NO
HNO3 (конц) + СuS →Cu(NO3)2 + H2SO4 + NO2 + H2O
HNO3(разб) + CuS →Cu(NO3)2 + S + NO + H2O
HNO3 (конц) + PbS →PbSO4 + NO2 + H2O
SO2 + KMnO4 + H2O →K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 →K2SO4 + Cr2(SO4)3 + H2O
K2FeO4 + HCl →FeCl3 + KCl + Cl2 + H2O
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
А Л К А Н Ы
Общая формула Cn H2n+2
R — РАДИКАЛ
—Cl2 (hv) →R1Cl,; R2Cl2 …
—O2 t→ CO2 + H2O + Q
—t →C + H2
—1500 C →C2H2 + 3H2 (для метана)
СnH2n+2 → — КРЕКИНГ →АЛКАН + АЛКЕН
— — H2 (Pt)→ АЛКЕН; АЛКИН…
—t (кат)→ ИЗОМЕР
—HNO3 400 C)→ RNO2 + H2O
П о л у ч е н и е
1. C + 2H2 (Pt) → CH4
2. Al4C3 + 12H2O →3CH4 + Al(OH)3
Be2C + 4 H2O →CH4 + 2Be(OH)2
3.CH3COONa + NaOH ( t ) →CH4 + Na2CO3
4. CH3COONa + 2H2O ( электролиз ) →С2H6 + H2 + 2NaOH + 2CO2
5. 2CH3Br + 2Na (t) →C2H6 + 2NaBr (реакция Вюрца)
6. CH2=CH2 + H2 (Ni) →C2H6
НЕПРЕДЕЛЬРЫЕ УГЛЕВОДОРОДЫ ( А Л К И Н Ы )
А Ц Е Т И Л Е Н О В Ы Е У Г Л Е В О Д О Р О Д Ы
Общая формулаCnH2n-2
—H2 (Ni, t )→ C2H4; C2H6
—2Cl2 →CHCl2-CHCl2
—HCl (HgCl2)→ CH2=CHCl
C2H2 → —H2O (H2SO4) р-я Кучерова→ СH3COH
—2C2H2 ( C акт 600 С)→ С6H6
—Ag2O (в р-ре NH3)→ Ag2C2
—C2H2 ( CuCl x NH4Cl)→ CH2=CH-C=CH
—HCN (CuCl x HCl)→ CH2=CH-CN
—CH3COOH (HgSO4 t)→ CH3COOCH=CH2
П О Л У Ч Е Н И Е
1. CH3-CH3 → C2H2 + 2H2
2. 2CH4 1500 C) →C2H2 + 3H2
3. 2CH4 + 1,5O2 →C2H2 + 3 H2O
4. CaC2 + 2H2O →C2H2 + Ca(OH)2
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ ( АЛКЕНЫ )
Э Т И Л Е Н О В Ы Е У Г Л Е В О Д О Р О Д Ы
Общая формулаCnH2n
—H2 (Ni )→ АЛКАН
—Br2 (вода)→ СnH2nBr2
CnH2n→ —HCl 400 C )→ CnH2n-1Cl (R-Cl )
—H2O (H2SO4)→ CnH2n+1OH (R-OH)
—[O] + H2O (KMnO4)→ CnH2n(OH)n [R-(OH)n]
— —H2 (Pt)→ АЛКИН
—O2 t →CO2 + H2O
nCH2=CH2 (катализ)→ПОЛИМЕР
П О Л У Ч Е Н И Е
1. C2H6 (Pt, t) → C2H4 + H2
2. CH2Cl-CH2Cl + Zn (t) → C2H4 + ZnCl2
3. CH3-CH2Cl + KOH(спиртовый) →C2H4 + KC l + H2O
4. CH3-CH2OH ( H2SO4 t) →C2H4 + H2O
5. C2H2 + H2 (Ni, t) →C2H4
А Р О М А Т И Ч Е С К И Е У Г Л Е В О Д О Р О Д Ы (А Р Е Н Ы )
Б Е Н З О Л
—Br2 (FeBr3)→ C6H5Br
—HNO3 (H2SO4)→C6H5NO2
C6H6 —H2 (Pt)→ C6H12
—Cl2 (hv)→ C6H6Cl6
—H2SO4→C6H5SO2OH
—CH3Br (FeBr3)→ C6H5-CH3 (толуол )
П О Л У Ч Е Н И Е
1. Из нефти
2. Из каменноугольного дегтя
3. С6Н10 (катализ) → С6Н6 + 3Н2
4. 3С2Н2 (актив. уголь, t) → C6H6
5. C6H6 (Pt, t) → C6H6 + 4H2O
Заместители 1 рода — −CH3; -Br; -OH; -OCH3; -NH2; -NHCH3; -N(CH3)) — имеют
только простые связи. Они направляют последующие заместители преимущественно
в 2-, 4-, и 6- положения
Заместители 2 рода — −NO2; -CN; -COH; -COOH; -SO3H; -COCH3) — имеют
кратные связи. Они направляют последующие заместители преимущественно в 3- и 5-
положения
О д н о а т о м н ы е С П И Р Т Ы
Общая формула — R-OH
—Na, K→ R-ONa + H2
—HBr (H2SO4) →R-Br
—CuO t→ R1-COH
R-OH→ — — H2O (H2SO4, t)→ CnH2n
— -H2O (H2SO4, t)→ R-O-R
—R1-COOH (H2SO4, t)→ R1-COO-R
П О Л У Ч Е Н И Е
1. С6H12O6 (дрожжи) → 2С2H5OH + CO2
2. C2H5Br + NaOH водн. →С2H5OH + NaBr
3. CH2=CH2 + H2O (AL2O3) →C2H5OH
4. CH3-COOH + H2 (Ni, t) → C2H5OH
5. C2H5-O-C2H5 + H2O −H+) → 2C2H5OH
6. CH3— COOH-C2H5 + H2O −H+; OH-) →CH3-COOH + C2H5OH
7. CO + 2H2 (синтез-газ) (Cr2O3, t, p)→ CH3OH
И з о м е р и я с п и р т о в
СH3-CH2-OH Первичный CH3-C-CH3 вторичны
↓
OH
СH3
третичный__ CH3-C-CH3
OH
Материалы по химии
Подготовка к ЕГЭ, ОГЭ, ДВИ
-
Свойства основных оксидов
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Читать далее…
Дата публикации 14.01.2023
-
Электролиты и неэлектролиты. Сильные и слабые электролиты
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Читать далее…
Дата публикации 10.10.2022
-
Репетитор химия ЕГЭ
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Читать далее…
Дата публикации 18.07.2022
-
Задание 8 ЕГЭ по химии
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Читать далее…
Дата публикации 20.04.2022
-
Разложение веществ
Разложение основных групп солей – карбонатов, нитратов, кислых, комплексных солей, разложение солей аммония. Реакции термического разложения перманганатов, дихроматов, бертолетовой соли, азотной и азотистой кислоты.
Читать далее…
Дата публикации 20.02.2022
-
Тривиальные названия ЕГЭ
Тривиальные названия ЕГЭ, тривиальные названия неорганических веществ в форме таблицы. Как выучить названия веществ. Таблица с тривиальными названиями
Читать далее…
Дата публикации 05.02.2022
-
Химия с нуля и до ЕГЭ
С чего начинать подготовку к ЕГЭ по химии, как организовать свою работу, если до экзамена осталось немного времени. Можно ли подготовиться к ЕГЭ за месяц? Основные правила для успешного прохождения экзамена.
Читать далее…
Дата публикации 17.01.2022
-
Водород
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Читать далее…
Дата публикации 19.12.2021
-
Щелочи: определение, химические свойства, методы получения
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Читать далее…
Дата публикации 09.12.2021
-
Дисперсные системы
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Читать далее…
Дата публикации 01.12.2021
- 1
- 2
- 3

Подготовка к ЕГЭ начинается с
психологического настроя на успех, обязательную сдачу ЕГЭ.
Поэтому не
лишними будут помощь психолога, советы родителей и учителей.
Теория к ЕГЭ. Методика самостоятельной подготовки к ЕГЭ
ТЕОРИЯ ДЛЯ СДАЮЩИХ ЕГЭ
Дopoнькин ЕГЭ. Химия. Большой справочник
Adobe Acrobat Document
7.6 MB
РАСПЕЧАТАТЬ И ИСПОЛЬЗОВАТЬ
Методические рекомендации по подготовке
Adobe Acrobat Document
375.5 KB
ПРОРАБОТАТЬ И ПРИНЯТЬ К СВЕДЕНИЮ
анализ типичных ошибок ЕГЭ-2019 г.pdf
Adobe Acrobat Document
771.7 KB
ПРОГРАММА ПОДГОТОВКИ К ЕГЭ ПО ХИМИИ.doc
Microsoft Word Document
129.5 KB
ВНИМАНИЕ
Тривиальные названия органических вещест
Adobe Acrobat Document
340.1 KB
Теория и тест для самостоятельной проработки.
Основные способы получения металлов.pptx
Microsoft Power Point Presentation
920.7 KB
Все свойства органических веществ.
Реакции к основным темам курса 10 класса
Microsoft Word Document
158.0 KB
Общие формулы. УЧИТЬ!!!
Общие формулы классов органических вещес
Adobe Acrobat Document
188.4 KB
Металлы. Соединения металлов. УЧИТЬ!!!
Свойства металлов и их соединений.docx
Microsoft Word Document
2.5 MB
Цепочки превращений.
Задание С3. Цепочки превращений..docx
Microsoft Word Document
674.8 KB
Теория по основным классам неорганических соединений.
Основные классы и их свойства.doc
Microsoft Word Document
880.0 KB
Нужно разобраться и выучить.
Ряд активности металлов.pdf
Adobe Acrobat Document
315.0 KB

Документация и подготовка к ЕГЭ
таблица ПСХЭ.doc
Microsoft Word Document
396.5 KB
Таблица растворимости некоторых веществ
Microsoft Word Document
578.5 KB

Дополнительная информация, теория к ЕГЭ
Адреса сайтов подготовки.
Материалы для подготовки к ОГЭ и ЕГЭ.doc
Microsoft Word Document
15.2 KB
Таблица. Качественные признаки веществ.d
Microsoft Word Document
44.8 KB
Ряд ЭО. Названия кислот и остатков. Степ
Microsoft Word Document
518.7 KB
Таблица ПСХЭ . С обозначением классов со
Microsoft Word Document
498.4 KB
цвета оксидов.doc
Microsoft Word Document
24.0 KB
Номенклатура неорганических веществ.doc
Microsoft Word Document
135.5 KB
Определение ионов. Качественные реакции.
Microsoft Word Document
51.0 KB
Часть представленных здесь материалов взята с
сайта учителя химии Сикорской О.Э.
| 1 | ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ | |
| 1.1 | Современные представления о строении атома | |
| 1.1.1 | Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов. | |
| 1.2 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам периодической таблицы химических элементов. | |
| 1.2.2 | Общая характеристика металлов IА–IIIА групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. | |
| 1.2.3 | Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в периодической системе химических элементов Д.И.Менделеева и особенностям строения их атомов. | |
| 1.3 | Химическая связь и строение вещества | |
| 1.3.1 | Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. | |
| 1.3.2 | Электроотрицательность. Степень окисления и валентность химических элементов. | |
| 1.3.3 | Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения. | |
| 1.4 | Химическая реакция | |
| 1.4.1 | Классификация химических реакций в неорганической и органической химии. | |
| 1.4.2 | Тепловой эффект химической реакции. Термохимические уравнения. | |
| 1.4.3 | Скорость реакции, ее зависимость от различных факторов. | |
| 1.4.4 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов. | |
| 1.4.5 | Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. | |
| 1.4.6 | Реакции ионного обмена. | |
| Особенности взаимодействия кислых солей со щелочами. | ||
| 1.4.7 | Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. | |
| Необратимый гидролиз бинарных соединений. | ||
| 1.4.8 | Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. | |
| 1.4.9 | Электролиз расплавов и растворов (солей, щелочей,кислот). | |
| 2 | НЕОРГАНИЧЕСКАЯ ХИМИЯ | |
| 2.1 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | |
| 2.2 | Химические свойства простых веществ — металлов | |
| 2.2.1 | Характерные химические свойства щелочных металлов. | |
| 2.2.2 | Характерные химические свойства бериллия, магния и щелочноземельных металлов. | |
| 2.2.3 | Характерные химические свойства алюминия. | |
| 2.2.4 | Химические свойства переходных металлов (меди, цинка, хрома, железа). | |
| 2.3 | Химические свойства простых веществ — неметаллов | |
| 2.3.1 | Химические свойства водорода и галогенов. | |
| 2.3.2 | Химические свойства кислорода и серы. | |
| 2.3.3 | Химические свойства азота и фосфора. | |
| 2.3.4 | Химические свойства углерода и кремния. | |
| 2.4 | Характерные химические свойства оксидов: основных, амфотерных, кислотных. | |
| 2.5 | Характерные химические свойства оснований и амфотерных гидроксидов. | |
| 2.6 | Характерные химические свойства кислот. | |
| 2.7 | Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка). | |
| 3 | ОРГАНИЧЕСКАЯ ХИМИЯ | |
| 3.1 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. | |
| 3.2 | Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. | |
| 3.3 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная). | |
| 3.4 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). | |
| 3.5 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. | |
| 3.6 | Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. | |
| 3.7 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. | |
| 3.8 | Биологически важные вещества: жиры, белки, углеводы (моносахарады, дисахариды, полисахариды) | |
| 3.8.1 | Жиры. | |
| 3.8.2 | Белки. | |
| 3.8.3 | Углеводы (моносахариды, дисахариды, полисахариды). | |
| 3.9 | Взаимосвязь органических соединений. | |
| 4 | МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ | |
| 4.1 | Экспериментальные основы химии | |
| 4.1.1 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. | |
| 4.1.2 | Методы разделения смесей и очистки веществ. | |
| 4.1.3 | Определение характера среды водных растворов веществ. Индикаторы. | |
| 4.1.4 | Качественные реакции на неорганические вещества и ионы. | |
| 4.1.5 | Качественные реакции органических соединений. | |
| 4.1.7 | Основные способы получения углеводородов. | |
| 4.1.8 | Основные способы получения кислородсодержащих соединений. | |
| 4.2 | Общие представления о промышленных способах получения важнейших веществ | |
| 4.2.1 | Понятие о металлургии: общие способы получения металлов. | |
| 4.2.2.1 | Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). | |
| 4.2.3 | Природные источники углеводородов, их переработка. | |
| 4.2.4 | Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки. | |
| 4.3 | Рачеты по химическим формулам и уравнениям реакций | |
| 4.3.1 | Расчеты с использованием понятия «массовая доля вещества в растворе». | |
| 4.3.2 | Расчеты объемных отношений газов при химических реакциях. | |
| 4.3.3 | Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ. | |
| 4.3.4 | Расчеты теплового эффекта реакции. | |
| 4.3.5 | Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). | |
| 4.3.6 | Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества. |

 Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.
Свойства основных оксидов на ОГЭ и ЕГЭ по химии. Взаимодействие основных оксидов с водой, кислотами, кислотными оксидами, амфотерными оксидами, восстановителями.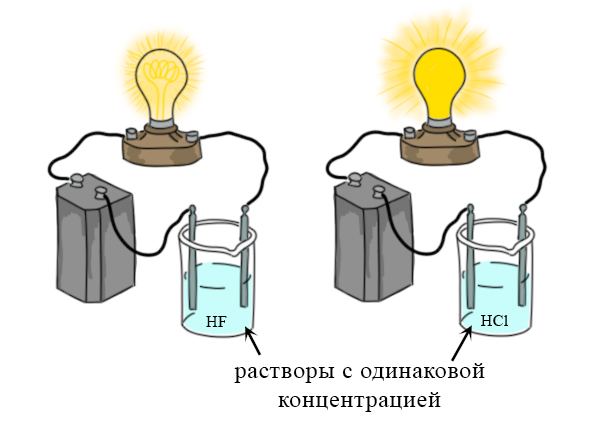 Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами?
Электролиты и неэлектролиты, сильные и слабые электролиты. Список сильных и слабых электролитов, и неэлектролитов. Почему загорается лампочка при соединении с некоторыми растворами? Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.
Репетитор по химии для подготовки к ЕГЭ на высокий балл. Подготовка к ЕГЭ по химии в Москве и дистанционно.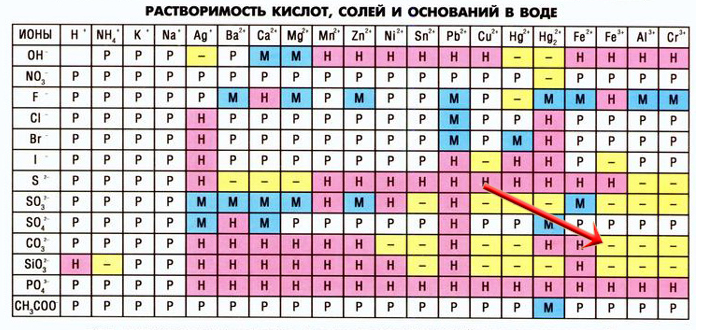 Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.
Неорганическая химия ЕГЭ. Задание 8 по химии теория и практика. Шпаргалки по химии. Как решать ЕГЭ по заданиям.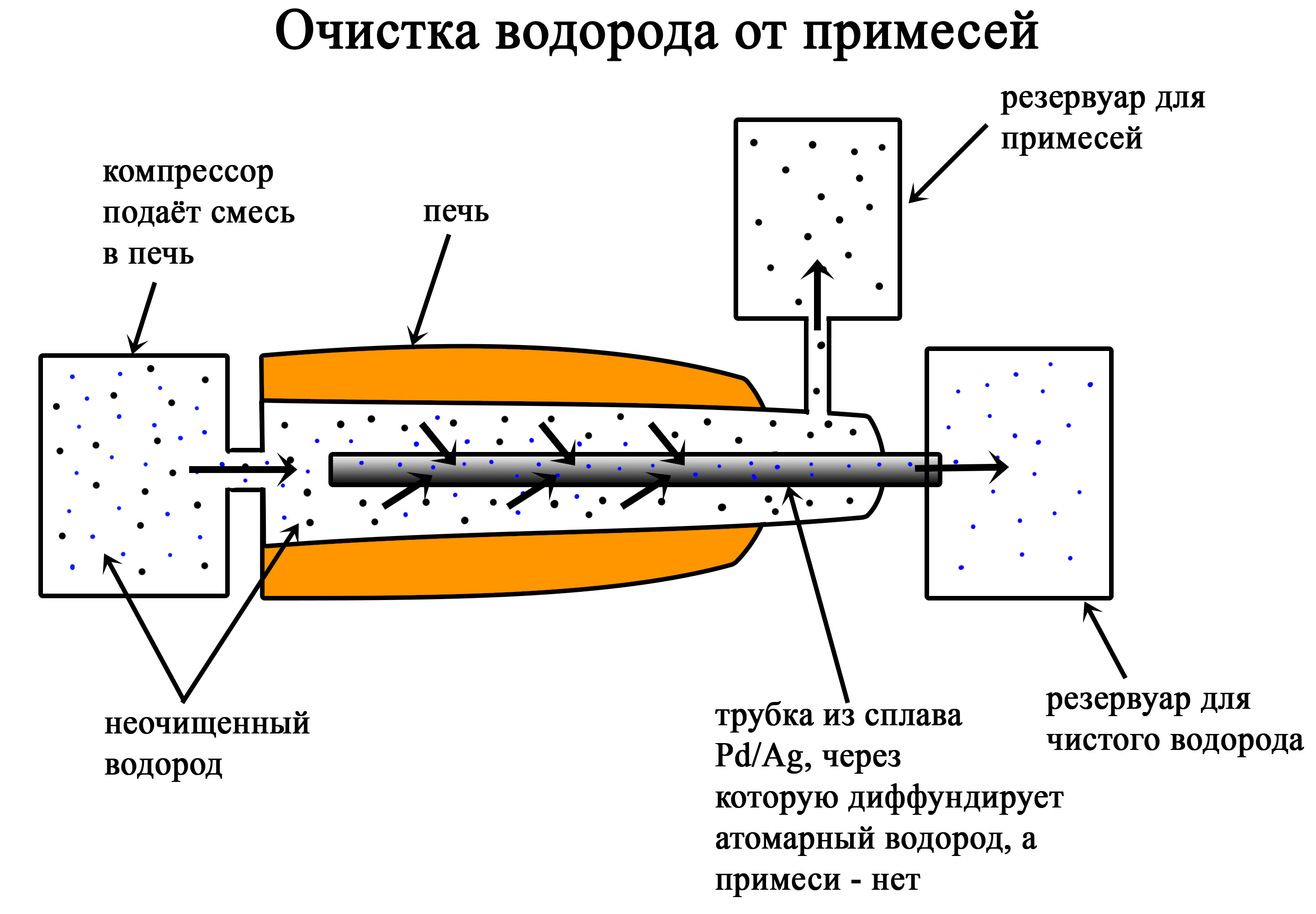 Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.
Водород на ЕГЭ по химии: получение водорода, положение в периодической системе. Реакция взаимодействия водорода с галогенами, металлами, халькогенами. Восстановительные свойства водорода.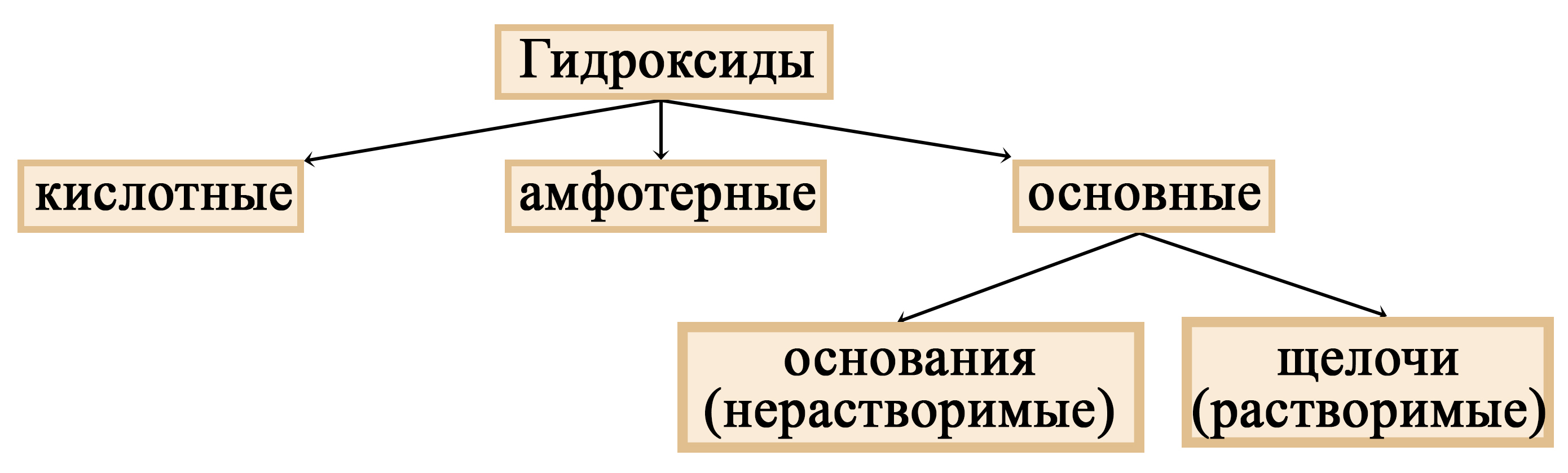 Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.
Реакции щелочей. Щелочь с кислотой. Соль и щелочь. Образование щелочи из оксида. Металлы со щелочами. Растворимые гидроксиды.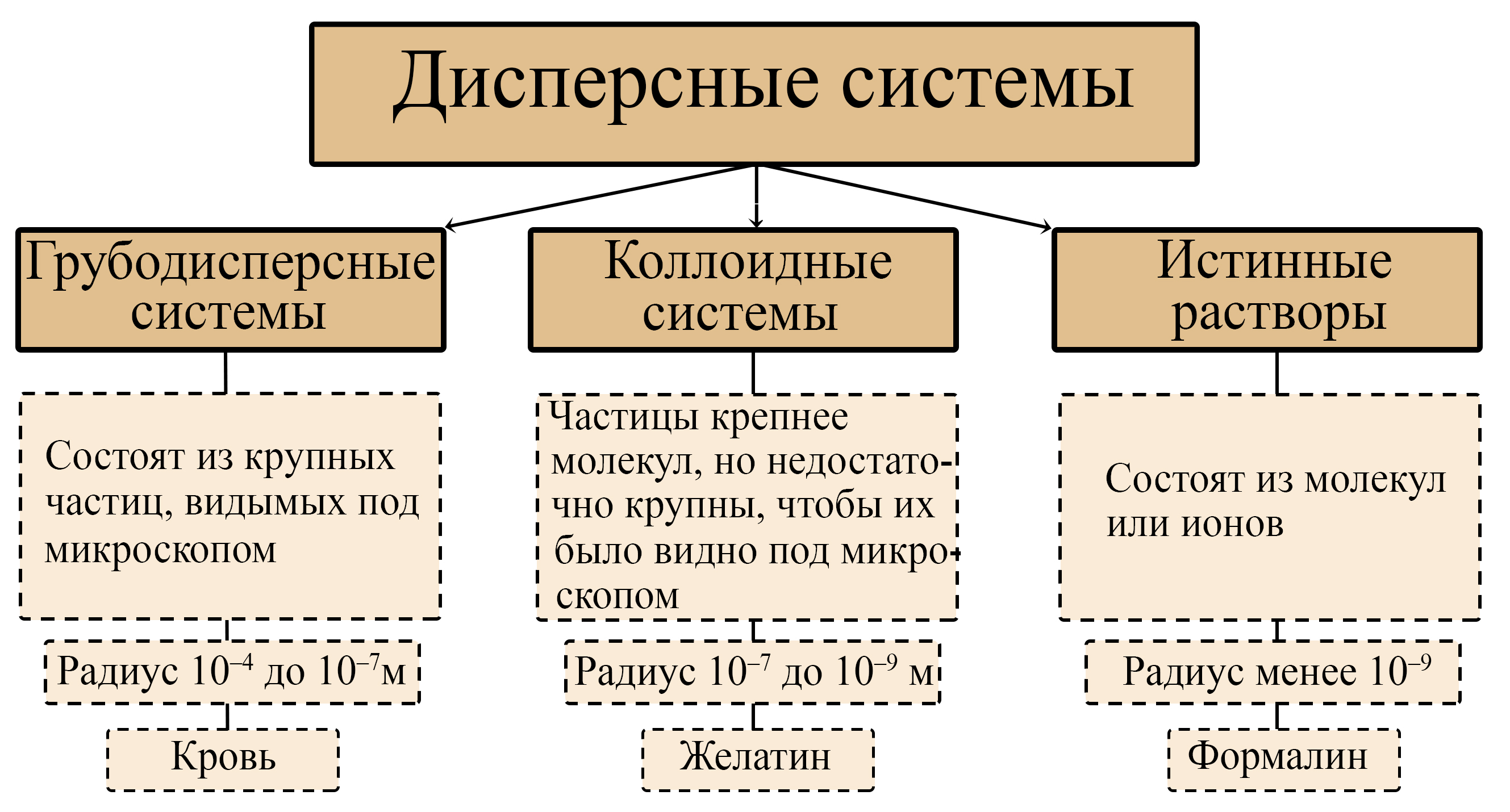 Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.
Кодификатор ФИПИ. Конспект к ЕГЭ. Гели и золи. Коллоиды. Виды дисперсных систем. Истинные растворы. ЕГЭ химия. Дисперсные системы 11 класс.