Десятичные приставки
| Наименование | Обозначение | Множитель |
| гига | Г | 109 |
| мега | М | 106 |
| кило | к | 103 |
| деци | д | 10–1 |
| санти | с | 10–2 |
| милли | м | 10–3 |
| микро | мк | 10–6 |
| нано | н | 10–9 |
| пико | п | 10–12 |
Физические постоянные (константы)
| число π | π = 3,14 |
| ускорение свободного падения | g = 10 м/с2 |
| гравитационная постоянная | G = 6,7·10–11 Н·м2/кг2 |
| газовая постоянная | R = 8,31 Дж/(моль·К) |
| постоянная Больцмана | k = 1,38·10–23 Дж/К |
| постоянная Авогадро | NA = 6,02·1023 1/моль |
| скорость света в вакууме | с = 3·108 м/с |
| коэффициент пропорциональности в законе Кулона | k = 1/(4πε0) = 9·109 Н·м2/Кл2 |
| модуль заряд электрона | e = 1,6·10-19 Кл |
| масса электрона | me = 9,1·10–31 кг |
| масса протона | mp = 1,67·10–27 кг |
| постоянная Планка | h = 6,62·10-34 Дж·с |
| радиус Солнца | 6,96·108 м |
| температура поверхности Солнца | T = 6000 K |
| радиус Земли | 6370 км |
Соотношение между различными единицами измерения
| температура | 0 К = –273 0С |
| атомная единица массы | 1 а.е.м. = 1,66·10–27 кг |
| 1 атомная единица массы эквивалентна | 931,5 МэВ |
| 1 электронвольт | 1 эВ = 1,6·10-19 Дж |
| 1 астрономическая единица | 1 а.е. ≈ 150 000 000 км |
| 1 световой год | 1 св. год ≈ 9,46·1015 м |
| 1 парсек | 1 пк ≈ 3,26 св. года |
Масса частиц
| электрона | 9,1·10–31кг ≈ 5,5·10–4 а.е.м. |
| протона | 1,673·10–27 кг ≈ 1,007 а.е.м. |
| нейтрона | 1,675·10–27 кг ≈ 1,008 а.е.м. |
Плотность
| воды | 1000 кг/м3 |
| древесины (сосна) | 400 кг/м3 |
| керосина | 800 кг/м3 |
| подсолнечного масла | 900 кг/м3 |
| алюминия | 2700 кг/м3 |
| железа | 7800 кг/м3 |
| ртути | 13 600 кг/м3 |
Удельная теплоёмкость
| воды | 4,2·10 3 Дж/(кг·К) |
| льда | 2,1·10 3 Дж/(кг·К) |
| железа | 460 Дж/(кг·К) |
| свинца | 130 Дж/(кг·К) |
| алюминия | 900 Дж/(кг·К) |
| меди | 380 Дж/(кг·К) |
| чугуна | 500 Дж/(кг·К) |
Удельная теплота
| парообразования воды | 2,3·10 6 Дж/кг |
| плавления свинца | 2,5·10 4 Дж/кг |
| плавления льда | 3,3·10 5 Дж/кг |
Нормальные условия:
| давление | 105 Па |
| температура | 00 C |
Молярная маcса молекул
| азота | 28·10–3 кг/моль |
| аргона | 40·10–3 кг/моль |
| водорода | 2·10–3 кг/моль |
| воздуха | 29·10–3 кг/моль |
| воды | 18·10–3 кг/моль |
| гелия | 4·10–3 кг/моль |
| кислорода | 32·10–3 кг/моль |
| лития | 6·10–3 кг/моль |
| неона | 20·10–3 кг/моль |
| углекислого газа | 44·10–3 кг/моль |
Таблица молярных масс химических элементов.
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅1023 моль−1).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12C.
Молярную массу обозначают M.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же.
Таблица молярных масс химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Молярная масса |
| 1 | Водород | H | 1,00784-1,00811 а.е.м. (г/моль) |
| 2 | Гелий | He | 4,002602(2) а.е.м. (г/моль) |
| 3 | Литий | Li | 6,938-6,997 а.е.м. (г/моль) |
| 4 | Бериллий | Be | 9,012182(3) а.е.м. (г/моль) |
| 5 | Бор | B | 10,806-10,821 а.е.м. (г/моль) |
| 6 | Углерод | C | 12,0096-12,0116 а.е.м. (г/моль) |
| 7 | Азот | N | 14,00643-14,00728 а.е.м. (г/моль) |
| 8 | Кислород | O | 15,99903-15,99977 а.е.м. (г/моль) |
| 9 | Фтор | F | 18,998403163(6) а.е.м. (г/моль) |
| 10 | Неон | Ne | 20,1797(6) а.е.м. (г/моль) |
| 11 | Натрий | Na | 22,98976928(2) а.е.м. (г/моль) |
| 12 | Магний | Mg | 24,304-24,307 а.е.м. (г/моль) |
| 13 | Алюминий | Al | 26,9815386(8) а.е.м. (г/моль) |
| 14 | Кремний | Si | 28,084-28,086 а.е.м. (г/моль) |
| 15 | Фосфор | P | 30,973762(2) а.е.м. (г/моль) |
| 16 | Сера | S | 32,059-32,076 а.е.м. (г/моль) |
| 17 | Хлор | Cl | 35,446-35,457 а.е.м. (г/моль) |
| 18 | Аргон | Ar | 39,948(1) а.е.м. (г/моль) |
| 19 | Калий | K | 39,0983(1) а.е.м. (г/моль) |
| 20 | Кальций | Ca | 40,078(4) а.е.м. (г/моль) |
| 21 | Скандий | Sc | 44,955912(6) а.е.м. (г/моль) |
| 22 | Титан | Ti | 47,867(1) а.е.м. (г/моль) |
| 23 | Ванадий | V | 50,9415(1) а.е.м. (г/моль) |
| 24 | Хром | Cr | 51,9961(6) а.е.м. (г/моль) |
| 25 | Марганец | Mn | 54,938045(5) а.е.м. (г/моль) |
| 26 | Железо | Fe | 55,845(2) а.е.м. (г/моль) |
| 27 | Кобальт | Co | 58,933194(4) а.е.м. (г/моль) |
| 28 | Никель | Ni | 58,6934(4) а.е.м. (г/моль) |
| 29 | Медь | Cu | 63,546(3) а.е.м. (г/моль) |
| 30 | Цинк | Zn | 65,38(2) а.е.м. (г/моль) |
Таблица молярных масс химических элементов (2 часть):
| 31 | Галлий | Ga | 69,723(1) а.е.м. (г/моль) |
| 32 | Германий | Ge | 72,630(8) а.е.м. (г/моль) |
| 33 | Мышьяк | As | 74,92160(2) а.е.м. (г/моль) |
| 34 | Селен | Se | 78,971(8) а.е.м. (г/моль) |
| 35 | Бром | Br | 79,901-79,907 а.е.м. (г/моль) |
| 36 | Криптон | Kr | 83,798(2) а.е.м. (г/моль) |
| 37 | Рубидий | Rb | 85,4678(3) а.е.м. (г/моль) |
| 38 | Стронций | Sr | 87,62(1) а.е.м. (г/моль) |
| 39 | Иттрий | Y | 88,90585(2) а.е.м. (г/моль) |
| 40 | Цирконий | Zr | 91,224(2) а.е.м. (г/моль) |
| 41 | Ниобий | Nb | 92,90638(2) а.е.м. (г/моль) |
| 42 | Молибден | Mo | 95,95(1) а.е.м. (г/моль) |
| 43 | Технеций | Tc | 97,9072 а.е.м. (г/моль) |
| 44 | Рутений | Ru | 101,07(2) а.е.м. (г/моль) |
| 45 | Родий | Rh | 102,90550(2) а.е.м. (г/моль) |
| 46 | Палладий | Pd | 106,42(1) а.е.м. (г/моль) |
| 47 | Серебро | Ag | 107,8682(2) а.е.м. (г/моль) |
| 48 | Кадмий | Cd | 112,411(8) а.е.м. (г/моль) |
| 49 | Индий | In | 114,818(1) а.е.м. (г/моль) |
| 50 | Олово | Sn | 118,710(7) а.е.м. (г/моль) |
| 51 | Сурьма | Sb | 121,760(1) а.е.м. (г/моль) |
| 52 | Теллур | Te | 127,60(3) а.е.м. (г/моль) |
| 53 | Йод | I | 126,90447(3) а.е.м. (г/моль) |
| 54 | Ксенон | Xe | 131,293(6) а.е.м. (г/моль) |
| 55 | Цезий | Cs | 132,9054519(2) а.е.м. (г/моль) |
| 56 | Барий | Ba | 137,327(7) а.е.м. (г/моль) |
| 57 | Лантан | La | 138,90547(7) а.е.м. (г/моль) |
| 58 | Церий | Ce | 140,116(1) а.е.м. (г/моль) |
| 59 | Празеодим | Pr | 140,90765(2) а.е.м. (г/моль) |
| 60 | Неодим | Nd | 144,242(3) а.е.м. (г/моль) |
Таблица молярных масс химических элементов (3 часть):
| 61 | Прометий | Pm | 144,9127 а.е.м. (г/моль) |
| 62 | Самарий | Sm | 150,36(2) а.е.м. (г/моль) |
| 63 | Европий | Eu | 151,964(1) а.е.м. (г/моль) |
| 64 | Гадолиний | Gd | 157,25(3) а.е.м. (г/моль) |
| 65 | Тербий | Tb | 158,92535(2) а.е.м. (г/моль) |
| 66 | Диспрозий | Dy | 162,500(1) а.е.м. (г/моль) |
| 67 | Гольмий | Ho | 164,93032(2) а.е.м. (г/моль) |
| 68 | Эрбий | Er | 167,259(3) а.е.м. (г/моль) |
| 69 | Тулий | Tm | 168,93421(2) а.е.м. (г/моль) |
| 70 | Иттербий | Yb | 173,045(10) а.е.м. (г/моль) |
| 71 | Лютеций | Lu | 174,9668(1) а.е.м. (г/моль) |
| 72 | Гафний | Hf | 178,49(2) а.е.м. (г/моль) |
| 73 | Тантал | Ta | 180,94788(2) а.е.м. (г/моль) |
| 74 | Вольфрам | W | 183,84(1) а.е.м. (г/моль) |
| 75 | Рений | Re | 186,207(1) а.е.м. (г/моль) |
| 76 | Осмий | Os | 190,23(3) а.е.м. (г/моль) |
| 77 | Иридий | Ir | 192,217(3) а.е.м. (г/моль) |
| 78 | Платина | Pt | 195,084(9) а.е.м. (г/моль) |
| 79 | Золото | Au | 196,966569(4) а.е.м. (г/моль) |
| 80 | Ртуть | Hg | 200,592(3) а.е.м. (г/моль) |
| 81 | Таллий | Tl | 204,382-204,385 а.е.м. (г/моль) |
| 82 | Свинец | Pb | 207,2(1) а.е.м. (г/моль) |
| 83 | Висмут | Bi | 208,98040(1) а.е.м. (г/моль) |
| 84 | Полоний | Po | 208,9824 а.е.м. (г/моль) |
| 85 | Астат | At | 209,9871 а.е.м. (г/моль) |
| 86 | Радон | Rn | 222,0176 а.е.м. (г/моль) |
| 87 | Франций | Fr | 223,0197 а.е.м. (г/моль) |
| 88 | Радий | Ra | 226,0254 а.е.м. (г/моль) |
| 89 | Актиний | Ac | 227,0278 а.е.м. (г/моль) |
| 90 | Торий | Th | 232,03806(2) а.е.м. (г/моль) |
| 91 | Протактиний | Pa | 231,03588(2) а.е.м. (г/моль) |
| 92 | Уран | U | 238,02891(3) а.е.м. (г/моль) |
| 93 | Нептуний | Np | 237,0482 а.е.м. (г/моль) |
| 94 | Плутоний | Pu | 244,0642 а.е.м. (г/моль) |
| 95 | Америций | Am | 243,061375 а.е.м. (г/моль) |
| 96 | Кюрий | Cm | 247,0703 а.е.м. (г/моль) |
| 97 | Берклий | Bk | 247,0703 а.е.м. (г/моль) |
| 98 | Калифорний | Cf | 251,0796 а.е.м. (г/моль) |
| 99 | Эйнштейний | Es | 252,083 а.е.м. (г/моль) |
| 100 | Фермий | Fm | 257,0951 а.е.м. (г/моль) |
| 101 | Менделевий | Md | 258,1 а.е.м. (г/моль) |
| 102 | Нобелий | No | 259,1009 а.е.м. (г/моль) |
| 103 | Лоуренсий | Lr | 266 а.е.м. (г/моль) |
| 104 | Резерфордий (Курчатовий) | Rf | 267 а.е.м. (г/моль) |
| 105 | Дубний (Нильсборий) | Db | 268 а.е.м. (г/моль) |
| 106 | Сиборгий | Sg | 269 а.е.м. (г/моль) |
| 107 | Борий | Bh | 270 а.е.м. (г/моль) |
| 108 | Хассий | Hs | 269 а. е. м. (г/моль) |
| 109 | Мейтнерий | Mt | 278 а. е. м. (г/моль) |
| 110 | Дармштадтий | Ds | 281 а. е. м. (г/моль) |
Коэффициент востребованности
23 847
Таблица молярных масс
| H+ | Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Fe2+ | Fe3+ | Zn2+ | Ag+ | Pb2+ | Cu2+ | |
| OH— | 18 | 24 | 56 | 40 | 35 | 171 | 74 | 58 | 78 | 90 | 107 | 99 | 125 | 241 | 98 |
| F— | 20 | 26 | 58 | 42 | 37 | 175 | 78 | 62 | 84 | 94 | 113 | 103 | 127 | 245 | 102 |
| Cl— | 36,5 | 42,5 | 74,5 | 58,5 | 53,5 | 208 | 111 | 95 | 133,5 | 127 | 162,5 | 136 | 143,5 | 278 | 135 |
| Br— | 81 | 87 | 119 | 103 | 98 | 297 | 200 | 184 | 267 | 216 | 296 | 225 | 188 | 367 | 223 |
| I— | 128 | 134 | 166 | 150 | 145 | 391 | 294 | 278 | 408 | 310 | — | 319 | 235 | 461 | 317 |
| S2- | 34 | 46 | 110 | 78 | 68 | 169 | 72 | 56 | 150 | 88 | 208 | 97 | 248 | 239 | 96 |
| SO32- | 82 | 94 | 158 | 126 | 116 | 217 | 120 | 104 | 294 | 136 | — | 145 | 296 | 287 | 144 |
| SO42- | 98 | 110 | 174 | 142 | 132 | 233 | 136 | 120 | 342 | 152 | 400 | 161 | 312 | 303 | 160 |
| NO3— | 63 | 69 | 101 | 85 | 80 | 261 | 164 | 148 | 213 | 180 | 242 | 189 | 170 | 331 | 188 |
| PO43- | 98 | 116 | 212 | 164 | 149 | 602 | 310 | 263 | 122 | 357 | 151 | 386 | 419 | 812 | 381 |
| CO32- | 62 | 74 | 138 | 106 | 96 | 197 | 100 | 84 | — | 116 | — | 125 | 276 | 267 | 142 |
| SiO32- | 78 | 90 | 154 | 122 | — | 213 | 116 | 100 | — | 132 | — | 141 | 292 | 283 | — |
|
№ |
Количественные |
Обозначение |
Единицы |
Формула |
|
1 |
Относительная атомная |
Аr |
— |
Ar = ma / u см. в периодической система химических элементов (ПСХЭ) |
|
2 |
Атомная единица массы |
u а.е.м. |
кг |
u=1/12 * ma(12C) const=1.66*10-27 |
|
3 |
Масса тома (абсолютная) |
ma |
кг |
ma = Ar * u |
|
4 |
Относительная молекулярная (формульная) масса вещества |
Mr |
— |
Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
|
5 |
Масса молекулы (формульной единицы) |
mM |
кг |
mM = Mr*u |
|
6 |
Количество вещества |
n |
моль |
n=m/M n=N/NA n=V/Vm |
|
7 |
Молярная масса (масса 1 моль вещества) |
M |
г/моль |
M=m/n M=Mr, M=Ar (для простых веществ) |
|
8 |
Масса вещества |
m |
г (кг) |
m=M*n m=ρ*V |
|
9 |
Число структурных единиц |
N |
атомов, молекул, ионов, частиц, формульных единиц (Ф.Е.) |
N=NA*n |
|
10 |
Молярный объем — число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) |
Vm |
л/моль |
const=22,4 |
|
11 |
Объем газа при н.у. |
V |
л |
V=Vm*n V=m/ρ |
|
12 |
Постоянная Авогадро |
NA |
частиц/моль |
const=6,02*1023 |
Вернуться в меню выбора предмета
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.

Таблицы DPVA.ru — Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
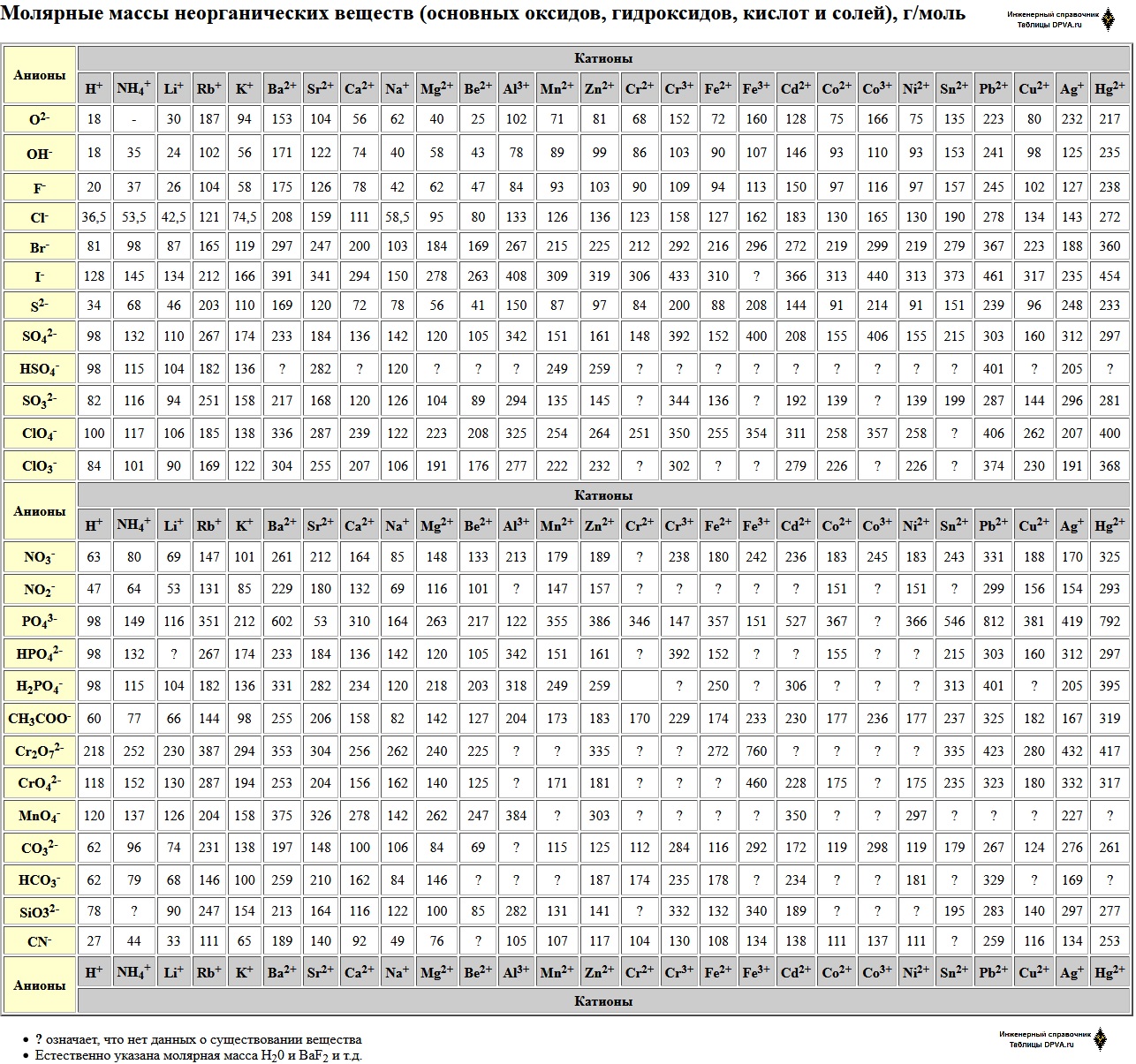
Молярные массы неорганических веществ (основных оксидов, гидроксидов, кислот и солей), г/моль
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator