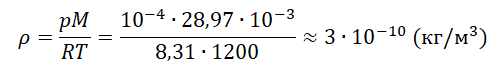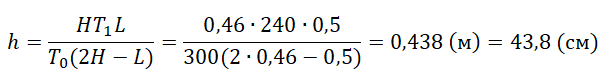в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 61 1–20 | 21–40 | 41–60 | 61–61
Добавить в вариант
Плотность водяного пара в воздухе при температуре T равна ρ. Плотность насыщенного водяного пара при этой температуре равна ρн. Молярная масса воды μводы = 18 г/моль, а сухого воздуха μвозд. = 29 г/моль. Установите соответствие между физическими величинами и формулами, по которым их можно определить. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
А) относительная влажность воздуха при температуре T
Б) парциальное давление водяного пара при температуре T
При температуре 250 K и давлении плотность газа равна
Какова молярная масса этого газа? Ответ приведите в килограммах на моль с точностью до десятитысячных.
На рисунке изображён график зависимости величины среднего значения квадрата скорости молекул идеального газа от температуры. Определите молярную массу этого газа. Ответ выразите в граммах на моль и округлите до целого числа.
На рисунке изображён график зависимости величины среднего значения квадрата скорости молекул идеального газа от температуры. Определите молярную массу этого газа. Ответ выразите в граммах на моль и округлите до целого числа.
Школьный класс имеет размеры пола 8 м × 12 м и высоту потолка 4,5 м. Осенью при атмосферном давлении 740 мм рт. ст. температура в классе равнялась 18 °C, а зимой, после похолодания и включения отопления температура повысилась до 24 °C при давлении 765 мм рт. ст. На сколько изменилось число молекул азота в классе? В воздухе содержится 78% азота по объёму. Молярная масса воздуха равна 29 кг/кмоль, объёмом учителя, учеников, мебели и учебных пособий можно пренебречь.
Установите соответствие между физическими величинами и их размерностями в СИ. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
А) Удельная теплота парообразования
Б) Молярная масса
РАЗМЕРНОСТЬ
1)
2) моль
3)
4) кг/моль
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Один литр жидкого неона находится при температуре своего кипения −246 °C. Какое количество теплоты нужно сообщить этому количеству неона для того, чтобы при постоянном давлении перевести его в газ, имеющий температуру 0 °C? Ответ выразите в килоджоулях и округлите до целого числа. (Плотность жидкого неона 1200 кг/м3, его удельная теплота испарения 164 кДж/кг, молярная масса — 0,020 кг/моль.)
В цилиндре под поршнем находится идеальный одноатомный газ. Формулы А и Б (p — давление; V — объём; ν — количество вещества; T — абсолютная температура) позволяют рассчитать значения физических величин, характеризующих состояние газа. Установите соответствие между формулами и физическими величинами, значение которых можно рассчитать по этим формулам. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФОРМУЛЫ
А)
Б)
ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
1) давление
2) объём
3) молярная масса газа
4) масса газа
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ — 2015. Досрочная волна.
Школьный класс имеет размеры пола 8 м × 12 м и высоту потолка 4,5 м. Осенью при атмосферном давлении 740 мм рт. ст. температура в классе равнялась 18 °C, а зимой, после похолодания и включения отопления температура повысилась до 24 °C при давлении 765 мм рт. ст. На сколько изменилось число молекул кислорода в классе? В воздухе содержится 21% кислорода по объёму. Молярная масса воздуха равна 29 кг/кмоль, объёмом учителя, учеников, мебели и учебных пособий можно пренебречь.
Источник: ЕГЭ по физике 06.06.2022. Основная волна. Разные задачи
Источник: ЕГЭ по физике 06.06.2022. Основная волна. Свердловская область
В кастрюлю положили кусок льда массой m = 1,5 кг с температурой t0 = 0 °C и поставили её на газовую горелку плиты. Когда лёд полностью расплавился, оказалось, что по счётчику был израсходован объём газа (метана с молярной массой 16 г/моль) V = 35 л. Найдите, сколько процентов составляли потери количества теплоты, полученного от сгорания газа. Давление газа считайте близким к нормальному атмосферному, температура газа T = 295 К, удельная теплота сгорания метана равна q = 50,1 МДж/кг.
В кастрюлю положили кусок льда массой m = 2 кг с температурой t0 = 0 °C и поставили её на газовую горелку плиты. Когда лёд полностью расплавился, оказалось, что по счётчику был израсходован объём газа (метана с молярной массой 16 г/моль) V = 40 л. Найдите, сколько процентов составляют тепловые потери от теплоты сгорания топлива. Давление газа считайте близким к нормальному атмосферному, температура газа T = 300 К, удельная теплота сгорания метана равна q = 50,1 МДж/кг.
В закрытом сосуде объёмом V находится влажный воздух при температуре T. Его относительная влажность равна Плотность насыщенных водяных паров при этой температуре равна
молярная масса воды
Установите соответствие между физическими величинами и формулами, по которым их можно рассчитать.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
А) масса воды в сосуде
Б) парциальное давление водяных паров в сосуде
Некоторое количество одноатомного идеального газа с молярной массой M находится при температуре T . Установите соответствие между пропущенным обозначением физической величины в формулах, представленных в левом столбце — для А) давления этого газа и Б) его внутренней энергии, и величинами, представленными в правом столбце.
К каждой позиции первого столбца подберите соответствующую позицию второго столбца.
ФОРМУЛА
A)
Б)
ОБОЗНАЧЕНИЕ
ФИЗИЧЕСКОЙ ВЕЛИЧИНЫ
1) V
2)
3)
4) N
Запишите в таблицу выбранные цифры под соответствующими буквами.
Парциальное давление водяного пара в воздухе при температуре T равно p. Давление насыщенного водяного пара при этой температуре равно pн. Молярная масса воды μводы = 18 г/моль, а сухого воздуха μвозд. = 29 г/моль. Установите соответствие между физическими величинами и формулами, по которым их можно определить. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
А) относительная влажность воздуха при температуре T
Б) плотность водяного пара при температуре T
В некотором процессе 1–2, который проводился с одним молем идеального одноатомного газа, среднеквадратичная скорость молекул газа возросла от u1 = 350 м/с до u2 = 380 м/с. При этом давление p газа в процессе оставалось постоянным, и газ совершил работу A = 292 Дж. Чему равна молярная масса этого газа?
В некотором процессе 1–2, который проводился с одним молем идеального одноатомного газа, среднеквадратичная скорость молекул газа возросла от u1 = 400 м/с до u2 = 450 м/с. При этом давление p газа в процессе оставалось постоянным, и внутренняя энергия газа увеличилась на = 425 Дж. Чему равна молярная масса
этого газа?
В закрытом сосуде объёмом V находится влажный воздух при температуре T. Его относительная влажность равна Давление насыщенных водяных паров при этой температуре равна
молярная масса воды
Установите соответствие между физическими величинами и формулами, по которым их можно рассчитать.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКАЯ ВЕЛИЧИНА
А) концентрация водяных паров в сосуде
Б) плотность водяных паров в сосуде
В закрытом сосуде с жёсткими стенками находится 0,2 моля гелия. Из сосуда выпускают половину газа и накачивают в сосуд взамен 0,1 моля аргона, поддерживая температуру неизменной.
Определите, как в результате этого изменяются следующие физические величины: давление в сосуде, удельная теплоёмкость содержимого сосуда. Для каждой величины определите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Давление в сосуде | Удельная теплоемкость содержимого сосуда |
Всего: 61 1–20 | 21–40 | 41–60 | 61–61
Тема 8.
Влажность. Тепловые явления
8
.
02
Водяной пар. Влажность
Вспоминай формулы по каждой теме
Решай новые задачи каждый день
Вдумчиво разбирай решения
ШКОЛКОВО.
Готовиться с нами — ЛЕГКО!
Подтемы раздела
влажность. тепловые явления
8.01Тепловые явления. Теплообмен
8.02Водяной пар. Влажность
Решаем задачи
На рисунке изображены два сосуда с влажным воздухом. Используя сведения, приведённые на рисунке,
определите отношение массы водяных паров, содержащихся в сосуде 2, к массе водяных паров,
содержащихся в сосуде 1.
В закрытом сосуде объёмом 10 л при температуре +27 находится воздух, имеющий влажность 60%.
Давление насыщенных паров воды при этой температуре равно 2000 Па. Какую массу воды надо
испарить в сосуде при данной температуре для того, чтобы влажность воздуха стала равна 100%? Ответ
выразите в миллиграммах и округлите до целого числа.
Указание:округлять только в конечном расчёте
Относительная влажность воздуха в закрытом сосуде равна 40%. Какой будет относительная влажность
воздуха в сосуде (в %), если при неизменной температуре уменьшить объём сосуда в 1,5
раза?
Показать ответ и решение
Влажность находится по формуле:
Здесь – давление пара,
– давление насыщенных паров.
из уравнения Бойля–Мариотта
При уменьшении объема в 1,5 раза давление возрастёт в 1,5 раза и влажность станет равна
60%
Относительная влажность воздуха в сосуде, закрытом поршнем, равна 30%. Какой станет относительная
влажность воздуха в сосуде, если объём сосуда при неизменной температуре увеличить в 1,5 раза? Ответ
дайте в процентах.
В закрытом сосуде при температуре 373 К под поршнем находится водяной пар под давлением 30 кПа.
Каким станет давление пара (в кПа), если, сохраняя его температуру неизменной, объём пара
уменьшить в 3 раза?
В воздухе комнаты при относительной влажности 40% парциальное давление водяного пара равно 980
Па. Найдите давление насыщенных паров (в Па) при данной температуре.
Показать ответ и решение
Влажность находится по формуле:
где
— парциальное давление водяного пара,
— давление насыщенного водяного пара.
Отсюда
Относительная влажность воздуха при температуре 100 равна 30%. Определите массу водяного
пара в двух литрах такого влажного воздуха. Ответ приведите в граммах, округлив до тысячных.
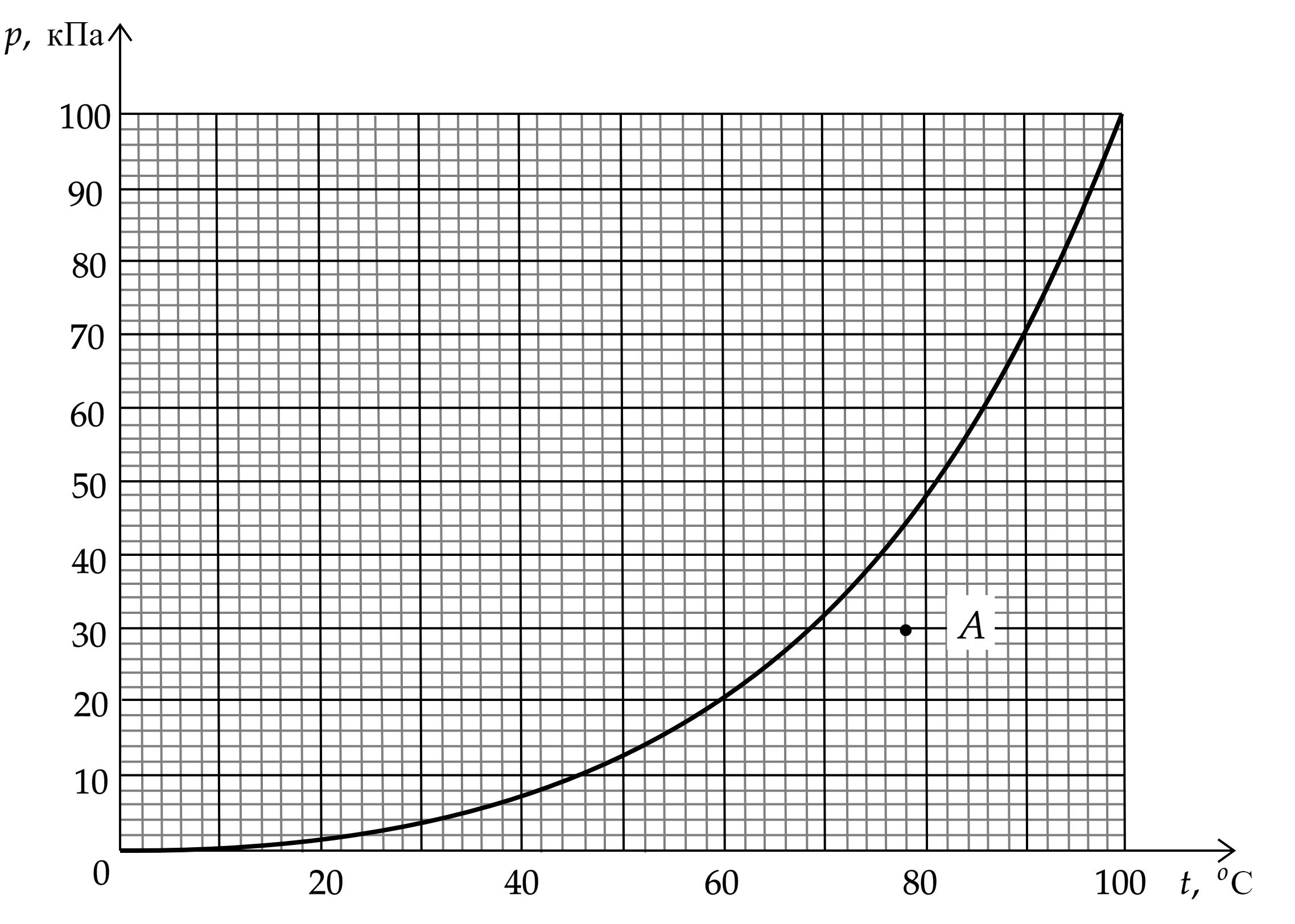
На рисунке изображена зависимость давления p насыщенного водяного пара от температуры T. Точкой
A на этом графике обозначено состояние пара, находящегося в закрытом сосуде. Чему равна
относительная влажность воздуха в этом сосуде? Ответ округлите до целого числа процентов.
Показать ответ и решение
Давление водяного пара в точке A:
Давление насыщенных паров при температуре точки А:
Найдем влажность воздуха:
В цилиндрический сосуд, герметично закрытый подвижным поршнем, впрыснули некоторое количество
воды, после чего сдвинули поршень и дождались установления в сосуде теплового равновесия —
получилось состояние 1. Затем поршень передвинули ещё раз, увеличив объём пространства под
поршнем в 3 раза при постоянной температуре. Оказалось, что в результате этого давление водяного
пара в сосуде уменьшилось в 1,5 раза (по сравнению с состоянием 1). Какая была относительная
влажность (в процентах) в сосуде в состоянии 1?
Показать ответ и решение
Так как при изменении объема в 3 раза, давление в сосуде уменьшилось только в 1,5 раза (а не в 3),
значит в ходе процесса изменилось количество водяного пара, то есть вода превращалась в пар
(происходил процесс испарения). Если происходил процесс испарения, то в начальный момент
влажность равна 100%
Относительная влажность воздуха в закрытом сосуде 25 %. Какой будет относительная
влажность, если объём сосуда при неизменной температуре уменьшить в 2 раза? (Ответ дать в
процентах.)
Показать ответ и решение
Влажность воздуха:
где
— давление водяных паров,
— давление насыщенных паров. Так как воздух
сжимают изотермически, то давление насыщенных паров не меняется, а давление водяных паров
увеличится во столько раз, во сколько уменьшается объем, следовательно, влажность станет
равна:
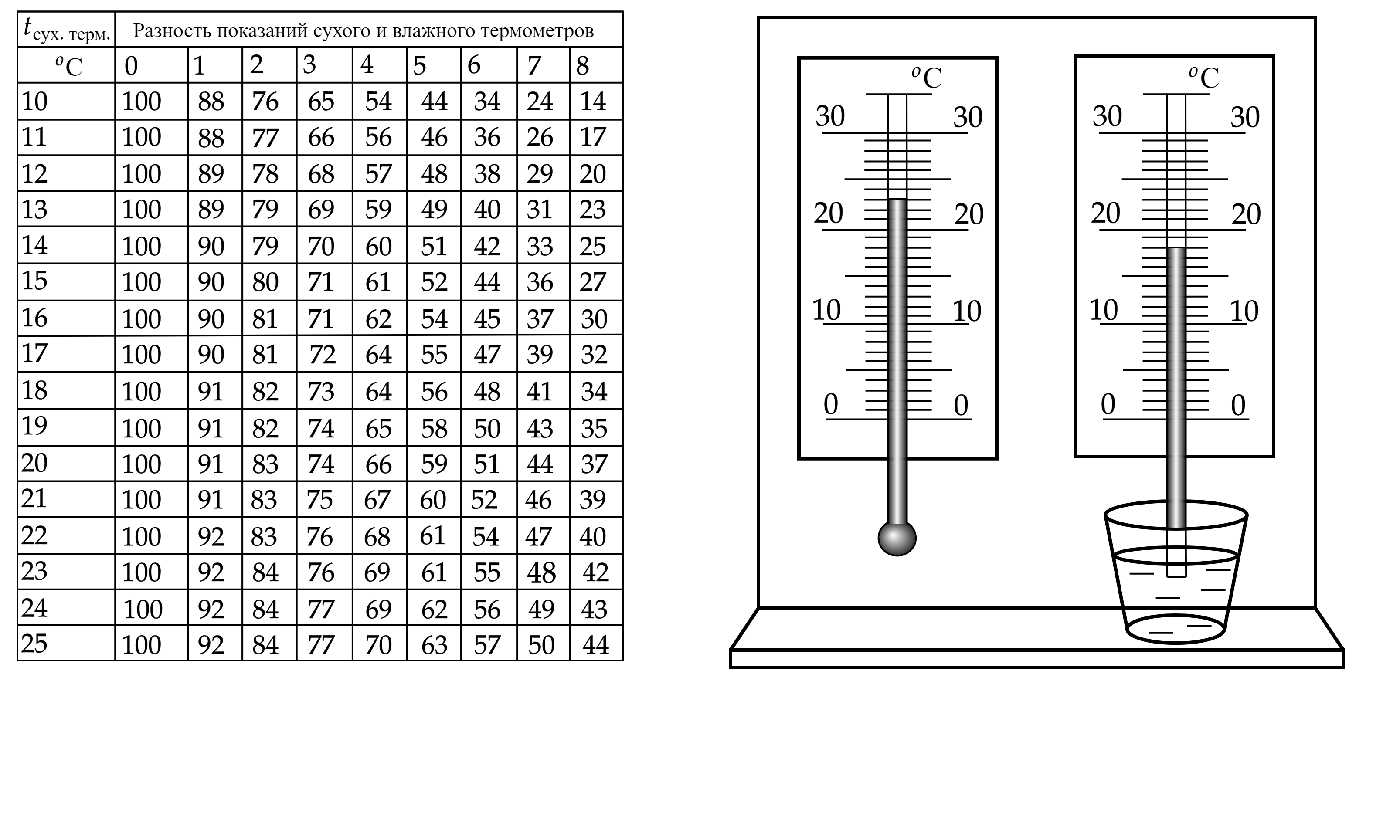
На рисунке представлены два термометра, используемые для определения относительной
влажности воздуха с помощью психрометрической таблицы, в которой влажность указана в
процентах.
Психрометрическая таблица представлена ниже. Какой была относительная влажность воздуха в тот
момент, когда проводилась съемка? (Ответ дайте в процентах.)
Показать ответ и решение
Показания сухого термометра:
Показания влажного термометра:
Разность температур:
Из таблицы определяем, что влажность воздуха
Относительная влажность воздуха в цилиндре под поршнем равна 40 %. Воздух изотермически сжали,
уменьшив его объем в 3 раза. Какова стала относительная влажность воздуха? (Ответ дайте в
процентах.)
Показать ответ и решение
Влажность воздуха:
где
— давление водяных паров,
— давление насыщенных паров.
Так как воздух сжимают изотермически, то давление насыщенных паров не меняется, а давление
водяных паров увеличится во столько раз, во сколько уменьшается объем, следовательно, влажность
станет равна:
Но
влажность не может быть больше 100%, следовательно, часть пара сконденсировалась и влажность
воздуха 100%
Относительная влажность воздуха в комнате равна 60%. Чему равно отношение концентрации молекул
воды в воздухе комнаты к концентрации молекул воды в насыщенном водяном паре при той же
температуре?
Давление насыщенного пара при температуре 15 равно 1,71 кПа. Если относительная влажность
воздуха равна 48 % то каково парциальное давление пара при температуре 15 ? (Ответ дайте в
кПа).
Показать ответ и решение
Влажность воздуха:
где — давление водяных паров,
— давление насыщенных паров. Выразим давление
водяных паров
Относительная влажность воздуха в закрытом сосуде 30 %. Какой станет относительная
влажность, если объём сосуда при неизменной температуре уменьшить в 3 раза? (Ответ дать в
процентах.)
Показать ответ и решение
Влажность воздуха:
где
— давление газа,
— давление насыщенных паров.
Так как воздух сжимают изотермически, то давление насыщенных паров не меняется, а давление
водяных паров увеличится во столько раз, во сколько уменьшается объем, следовательно, влажность
станет равна:
Относительная влажность порции воздуха при некоторой температуре равна 10 %. Во сколько раз
следует изменить давление этой порции воздуха для того, чтобы при неизменной температуре его
относительная влажность увеличилась на 45 %?
Показать ответ и решение
Влажность:
где
— давление газа,
— давление насыщенных паров. Для того чтобы увеличить влажность
воздуха в на 45 (с 10 % до 55 %), надо увеличить давление воздуха при неизменной температуре в
5,5 раз.
Парциальное давление водяных паров, содержащихся в воздухе при температуре 100 , равно 50 кПа.
Определите относительную влажность воздуха. Ответ выразите в процентах.
Относительная влажность воздуха в комнате равна 40 %. Давление насыщенного водяного пара при той
же температуре равно 1,2 кПа. Атмосферное давление равно 100 кПа. Чему равно парциальное давление
водяного пара в комнате? (Ответ дайте в Па.)
Показать ответ и решение
Влажность:
где
— давление газа,
— давление насыщенного водяного пара.
Определите плотность водяного пара в воздухе, который находится при температуре 100 , если
известно, что относительная влажность этой порции воздуха равна 40 %. Ответ приведите в кг/м и
округлите до сотых долей.
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H6O) |
58,08 |
|
Н-бутан (C4H10) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (H2) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10H22) |
142,30 |
|
Дифенил ( C12H10) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O2) |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
|
Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2H4) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
Хлористый этил (C2H5Cl) |
64,52 |
Чему равна молярная масса воздуха?
-
- 2
-
Завтра самастоятельная работа по химии а я не разбираюсь!! Скажите какую величину имеет молярная масса воздуха и формулы еще.
-
- 3
-
Измаил, молярная масса воздуха составляет приблизительно 29 грамм/моль.
Данное число считается приблизительным, так как воздух имеет смесь газов и состоит из таких частиц как:
- Углекислый газ CO2 (0,04%) = 44 г/моль
- Кислорода O2 (20%) = 32 г/моль
- Азот N2 (78%) = 28 г/моль
- Водород H2 и инертные газы (гелий He) (1%) = 2 г/моль
Из этого вычисляется точная молярная масса воздуха:
- Возьмем произведение каждого вещества и суммируем все смеси вместе, получившуюся сумму делим на 100% и получаем правильный ответ.
(78*28+20*32+1*2+0,04*44)/100% = 28,27 г/моль - Также молярная масса вещества, находящегося в таблице Менделеева, находится по очень простому способу, она равна относительной атомной массе элемента, например элемент №9 имеет молярную массу ~19, и ниже предоставлена картинка разбора элемента — Фтор (F).

-
- 1
-
Если нужно, то еще существует молекулярная масса, также уж на примере Фтора как выше, рассчитаем ее по формуле:
Так как Фтор двухатомный газ, то он имеет две молекулы F2.
F2 = 2*19 = 38 а. е. м.
Молярная и молекулярная масса вещества это довольно разные вещи, никогда не путайте их. На картинке можете еще посмотреть решенные примеры.

-
- 0
-
спасибо всем:) очень помогли!!
-
- 0
-
Молярная масса – это соотношение общей массы какого-либо вещества к числу молей, т.е. вес 1 моля. Воздух неоднороден по своему составу и состоит из нескольких веществ – азота, кислорода и небольшого количества других газов.
Чтобы определить молярную массу любого сложносоставного вещества нужно посчитать взвешенное среднее арифметическое значение, согласно долям каждого входящего элемента.
Авторизуйтесь чтобы ответить
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа
Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м3 под давлением 8,3∙105 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:
Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 оС | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 оС) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы |
Важна только та масса, что осталась в сосуде. Поэтому: m2 = 0,3m1 |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы:
m1 – m2 |
| Газ потерял половину молекул | |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10–3 кг/моль
M (O2) = 2Ar (O)∙10–3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К
Давление p0 = 105 Па |
| Единицы измерения давления | 1 атм = 105 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙106 Па
1,5 МПа = 1,5∙106 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:
Преобразим уравнения и получим:
Приравняем правые части и выразим искомую величину:
Задание EF19012

Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22473
На высоте 200 км давление воздуха составляет примерно 10–9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Ответ:
а) 8,31⋅ 10–11 кг/м3
б) 1,38⋅ 10–9 кг/м3
в) 3⋅ 10–10 кг/м3
г)29⋅ 10–8 кг/м3
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение Менделеева — Клапейрона.
3.Выразить из уравнения плотность.
4.Подставить известные данные и сделать вычисления.
Решение
Запишем исходные данные:
• Давление воздуха на высоте 200 км: p = 10–9∙105 Па. Или p = 10–4 Па.
• Температура воздуха на этой же высоте: T = 1200 К.
Запишем уравнение Менделеева — Клапейрона:
pV=mMRT
Плотность определяется формулой:
ρ=mV
Следовательно, масса равна произведению плотности на объем. Перепишем уравнение состояния идеального газа, учитывая, что объем сократится слева и справа:
p=ρMRT
Молярная масса воздуха — табличная величина, равная 28,97 г/моль. Переведем в СИ и получим 28,97∙10–3 кг/моль.
Выразим и вычислим плотность:
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22749

Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
Алгоритм решения
1.Записать уравнение состояния идеального газа и выразить из него объем. Выбрать из таблицы соответствующий номер формулы.
2.Определить, от чего зависит внутренняя энергия идеального газа.
3.Записать основное уравнение МКТ и выразить внутреннюю энергию идеального газа. Выбрать из таблицы соответствующий номер формулы.
Решение
Уравнение состояния идеального газа имеет вид:
pV=mMRT
Учтем, что отношение массы к молярной массе есть количество вещества.Отсюда объем равен:
V=νRTp
Следовательно, первой цифрой ответа будет «1».
Внутренняя энергия идеального газа равна сумме кинетических энергий всех молекул этого газа:
E=N−Ek
Запишем основное уравнение МКТ:
p=nkT
Отсюда температура газа равна:
T=pnk
Но температура прямо пропорциональна средней кинетической энергии молекул газа:
T=2−Ek3k
Следовательно:
pnk=2−Ek3k
−Ek=3p2n
E=N−Ek=N3p2n
Но концентрация определяется отношением количества молекул к объему. Следовательно:
E=N3pV2N=3pV2
А произведение давления на объем можно выразить через уравнение Менделеева — Клапейрона. Следовательно:
E=32νRT
Вторая цифра ответа будет «3».
Ответ: 13
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF22795
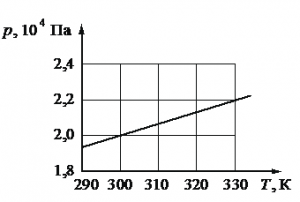
Алгоритм решения
1.Записать исходные данные.
2.Выбрать любую точку графика и извлечь из нее дополнительные данные.
3.Записать уравнение состояния идеального газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и вычислить искомую величину.
Решение
Запишем исходные данные. Объем сосуда равен: V = 0,25 м3. На графике выберем точку, соответствующую температуре T = 300 К. Ей соответствует давление p = 2∙104 Па.
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда количества вещества равно:
ν=pVRT=2·104·0,258,31·300≈2 (моль)
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17664
Зависимость объёма идеального газа от температуры показана на VТ-диаграмме (см. рисунок). В какой из точек давление газа максимально? Масса газа постоянна.
Ответ:
A
B
C
D
Алгоритм решения
1.Записать уравнение состояния идеального газа.
2.Установить, как зависит давление от объема и температуры газа.
3.На основании графика, отображающего изменение температуры и объема газа, установить, в какой точке давление газа максимально.
Решение
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда видно, что давление прямо пропорционально температуре. Это значит, что с ростом температуры давление увеличивается.
Также видно, что давление обратно пропорционально объему. Следовательно, давление увеличивается с уменьшением объема.
Отсюда следует, что давление будет максимальным в той точке, в которой температура максимальна, а объем минимален. Такой точкой является точка D.
Ответ: D
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18093
В камере, заполненной азотом, при температуре К находится открытый цилиндрический сосуд (см. рис. 1). Высота сосуда
см. Сосуд плотно закрывают цилиндрической пробкой и охлаждают до температуры
К. В результате расстояние от дна сосуда до низа пробки становится равным h (см. рис. 2). Затем сосуд нагревают до первоначальной температуры T0. Расстояние от дна сосуда до низа пробки при этой температуре становится равным
см (см. рис. 3). Чему равно h? Величину силы трения между пробкой и стенками сосуда считать одинаковой при движении пробки вниз и вверх. Массой пробки пренебречь.
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения физических величин в СИ.
2.Записать уравнение Менделеева — Клапейрона и применить его ко всем состояниям газа.
3.Определить условие равновесия пробки.
4.Выполнить решение задачи в общем виде.
5.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Начальная температура азота: T0 = 300 К.
• Высота сосуда: L = 50 см.
• Температура азота после охлаждения: T1 = 240 К.
• Высота столба азота после нагревания: H = 46 см.
50 см = 0,5 м
46 см = 0,46 м
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество азота не меняется, можем принять, что:
pVT=const
Применим уравнение Менделеева — Клапейрона для всех трех состояний азота. Учтем, что
p0V0T0=p1V1T1=p2V2T2
Пусть S — площадь поперечного сечения сосуда. Тогда объемы столба азота для каждого из состояний будут равны:
V0=SL
V1=Sh
V2=SH
Известно, что в состоянии 3 температура азота поднимается до первоначальной. Поэтому уравнение Менделеева — Клапейрона примет вид:
p0SLT0=p1ShT1=p2SHT0
p0LT0=p1hT1=p2HT0
Неизвестными остались только давления. Их можно определить, записав условие равновесия пробки.
В состоянии 1 сила давления азота на пробку определяется формулой:
p0S=pатмS
В состоянии 2 на пробку действует сила давления со стороны азота и атмосферного давления, я а также сила трения, направленная вверх. Следовательно:
p1S=pатмS−Fтр=p0S−Fтр
В состоянии 3 на пробку действуют те же силы, но сила трения теперь действует не вверх, а вниз. Поэтому:
p2S=pатмS+Fтр=p0S+Fтр
Выразим из этих уравнений силу трения:
Fтр=p0S−p1S
Fтр=p2S−p0S
Приравняем правые части и получим:
p0S−p1S=p2S−p0S
Отсюда:
p0−p1=p2−p0
2p0=p2+p1
p0=p2+p12
Подставим это значение в уравнение Менделеева — Клапейрона и получим:
p2+p12LT0=p1hT1=p2HT0
Отсюда:
p2+p12L=p2H
p2L+p1L=2p2H
p1L=2p2H−p2L=p2(2H−L)
p1=p2(2H−L)L
Отсюда:
p2(2H−L)LhT1=p2HT0
Давление слева и справа взаимоуничтожается. Остается:
T0(2H−L)Lh=HT1
Отсюда выразим h:
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18873

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | Просмотров: 6.2k
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти молярную массу воздуха
Молярная масса — это масса одного моля вещества, то есть величина, показывающая, в каком количестве вещества содержится 6,022*10 (в степени 23) частиц (атомов, молекул, ионов). А если речь идет не о чистом веществе, а о смеси веществ? Например, о жизненно необходимом человеку воздухе, ведь он представляют собою смесь великого множества газов. Как вычислить его молярную массу?

Вам понадобится
- — точные лабораторные весы;
- — круглодонная колба со шлифом и краном;
- — вакуумный насос;
- — манометр с двумя кранами и соединительными шлангами;
- — термометр.
Инструкция
Прежде всего подумайте над допустимой погрешностью вычислений. Если вам не нужна высокая точность, ограничьтесь лишь тремя самыми «весомыми» компонентами: азотом, кислородом и аргоном, и возьмите «округленные» величины их концентраций. Если же необходим более точный результат, то используйте в расчетах еще и углекислый газ и можете обойтись без округления.
Предположим, что вас устроит первый вариант. Напишите молекулярные массы этих компонентов и их массовые концентрации в воздухе:
— азот (N2). Молекулярная масса 28, массовая концентрация 75,50%;
— кислород (О2). Молекулярная масса 32, массовая концентрация 23,15%;
— аргон (Ar). Молекулярная масса 40, массовая концентрация 1,29%.
Для облегчения расчетов, округлите величины концентраций:
— для азота – до 76%;
— для кислорода – до 23%;
— для аргона – до 1,3%.
Произведите несложное вычисление:
28* 0,76 + 32* 0,23 + 40*0, 013 = 29,16 граммов/моль.
Полученная величина очень близка к той, которая указана в справочниках: 28,98 граммов/моль. Расхождение объясняется округлением.
Можете определить молярную массу воздуха и с помощью несложного лабораторного опыта. Для этого измерьте массу колбы с находящимся в ней воздухом.
Запишите полученный результат. Потом, подсоединив шланг колбы к манометру, откройте кран и, включив насос, начните откачивать воздух из колбы.
Подождите некоторое время (чтобы воздух в колбе нагрелся до комнатной температуры), запишите показания манометра и термометра. Затем, закрыв кран на колбе, отсоедините ее шланг от манометра, и взвесьте колбу с новым (уменьшенным) количеством воздуха. Запишите результат.
Далее вам на помощь придет универсальное уравнение Менделеева-Клапейрона:
PVm = MRT.
Запишите его в несколько измененном виде:
∆PVm = ∆MRT, причем вам известны и изменение давления воздуха ∆P и изменение массы воздуха ∆M. Молярная масса воздуха m вычисляется элементарно: m = ∆MRT/∆PV.
Полезный совет
Уравнение Менделеева-Клапейрона описывает состояние идеального газа, которым воздух, конечно же, не является. Но при величинах давления и температуры, близких к нормальным, погрешности настолько незначительны, что ими можно пренебречь.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.