Каталог заданий
Версия для печати и копирования в MS Word
1
Задания Д5 B8 № 3209
Какая масса у 3 моль неона?
1) 12 г
2) 36 г
3) 60 г
4)
Решение
·
·
1 комментарий · Сообщить об ошибке · Помощь
← Молярная и молекулярная масса
- Относительная молекулярная масса Ne: 20.1797
- Молярная масса Ne: 20.1797 г/моль (0.02018 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Ne (неон) | 1 | 20.1797 | 20.1797 |
| 20.1797 |
Расчёт молярной и относительной молекулярной массы Ne
- Mr[Ne] = Ar[Ne] = 20.1797 = 20.1797
- Молярная масса (в кг/моль) = Mr[Ne] : 1000 = 20.1797 : 1000 = 0.02018 кг/моль
Электронная конфигурация атома неона
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C2H2CuO4 [153.58088]
Cr2O12S3 [392.18]
Калькулятор молекулярной массы

Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H6O) |
58,08 |
|
Н-бутан (C4H10) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (H2) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10H22) |
142,30 |
|
Дифенил ( C12H10) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O2) |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
|
Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2H4) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
Хлористый этил (C2H5Cl) |
64,52 |
11. МКТ и Термодинамика (объяснение явлений)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
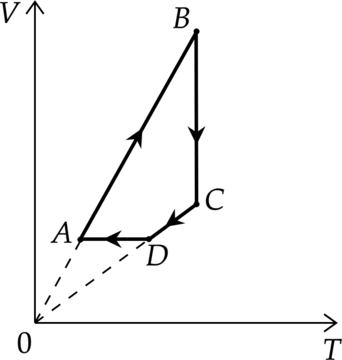
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах (V-T), где (V) — объём газа, (T) — абсолютная температура газа. Количество вещества газа постоянно.
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике, и укажите их номера.
1) В состоянии (B) концентрация газа максимальна.
2) В процессе (AB) газ отдаёт некоторое количество теплоты.
3) В процессе (BC) внутренняя энергия газа увеличивается.
4) Давление газа в процессе (CD) постоянно, при этом внешние силы совершают над газом положительную работу.
5) В процессе (DA) давление газа изохорно уменьшается.
1) В точке (B) объем максимален, а концентрация минимальна:
Утверждение 1 —(color{red}{smalltext{Неверно }})
2) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. В процессе (AB) работа равна (0), температура увеличивается, то есть (Delta U>0), значит (Q>0), то есть газ получает тепло
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс (BC) — изотермический. Внутренняя энергия не меняется.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Процесс (СD) — изобарное сжатие. При уменьшении объема внешние силы совершают положительную работу.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) Процесс (DA) — изохорное охлаждение ((psim T)). Следовательно, при уменьшении температуры давление уменьшается.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Идеальный газ перевели из состояния 1 в состояние 3 так, как показано на графике зависимости давления р газа от объёма V. Количество вещества газа при этом не менялось. 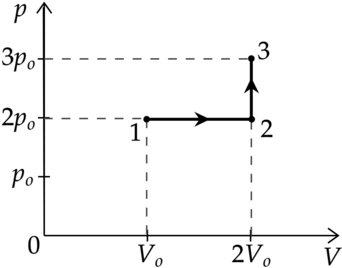
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике.
1)Абсолютная температура газа минимальна в состоянии 2.
2)В процессе 1-2 абсолютная температура газа уменьшилась в 2 раза.
3)В процессе 2-3 абсолютная температура газа уменьшилась в 1,5 раза.
4)Плотность газа максимальна в состоянии 1.
5)В ходе процесса 1-2-3 средняя квадратичная скорость теплового движения молекул газа увеличилась в (sqrt{3}) раза.
1) Уравнение состояния газа: [pV=nu RT] где (p) — давление газа, (V) — объем, занимаемый газом, (nu) — количество вещеста, (R) — универасальная газовая постоянная, (T) — температура. Температура максимальна там, где максимально произведение (pV), поэтому из графика видно, что (T_1 — min), (T_3 — max), (T_1<T_2<T_3)
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Процесс 1-2 — изобарное расширение ((Vsim T)). Объем увеличился в 2 раза, то есть температура тоже увеличилась в 2 раза.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс 2-3 — изохорное нагревание. (V=const), следовательно (psim T) Давление увеличивается в 1,5 раза, то есть температура тоже увеличивается в 1,5 раза.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) В точке 1 — объем минимален, следовательно, плотность там максимальна.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] где (m_0) — масса газа, (v^2) средняя квадратичная скорость [v^2sim T] [vsim sqrt{T}] Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в (sqrt{3}) раз
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 40 г неона, в правой — 2 моль гелия. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул неона. Температура газов одинакова и остаётся постоянной.
Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Внутренняя энергия гелия в сосуде меньше, чем внутренняя энергия неона.
2) Концентрация гелия в левой части сосуда в 2 раза больше концентрации неона.
3) В левой части сосуда общее число молекул газов в 3 раза больше, чем в правой части.
4) Внутренняя энергия гелия в сосуде в конечном состоянии меньше, чем в начальном.
5) В конечном состоянии давление в левой части сосуда в 3 раза больше, чем в правой.
1) Молярная масса неона (M=20) г/моль. Количество неона: [nu=dfrac{m}{M}=dfrac{40text{ г}}{20text{ г/моль}}=2 text{ моль}] Гелий займет все пространство сосуда, значит в левой части будет 3 моля вещества (1 моль гелия и 2 моль неона).
В правой части будет тоже 1 моль гелия.
Внутренняя энергия газа: [U=dfrac{i}{2}nu RT] Газы находятся при одинаковой температуре, количество гелия равно количеству неона. Внутренняя энергия гелия равна внутренней энергии неона
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) В левой части сосуда количество гелия в два раза меньше количества неона. Следовательно, концентрация гелия в два раза меньше концентрации неона.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Так как количество вещества в левой части сосуда больше в 3 раза, чем в правой, то и количество молекул также больше в 3 раза.
Утверждение 3 — (color{green}{smalltext{Верно }})
4) Так как температура гелия и общее количество гелия в сосуде не изменилось, то и внутреннняяя энергия не поменялась.
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) Давление газа: [p=nkT] Так как кол-во вещества в левой части сосуда больше в 3 раза, чем в правой, температуры одинаковые, то давление в конечном состоянии больше в левой части в 3 раза, чем в правой.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 35
Объём сосуда с идеальным газом увеличили вдвое и добавили в сосуд такое же количество того же газа. Температура в сосуде поддерживается постоянной.
Выберите два верных утверждения, описывающих этот процесс.
1) Давление газа в этом процессе увеличилось в 4 раза.
2) Внутренняя энергия газа в сосуде увеличилась.
3) Концентрация молекул газа в сосуде уменьшилась.
4) Давление газа в результате этого процесса не изменилось.
5) Плотность газа в сосуде увеличилась.
1) Уравнение состояния газа: [pV=nu RT] [p=dfrac{nu RT}{V}] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Так как и числитель, и знаменатель увеличился в 2 раза, то давление газа не изменится.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Внутренняя энергия газа: [U=dfrac{i}{2}nu RT] Температура не изменилась, количество газа увеличилось, следовательно, внутренняя энергия газа увеличилась.
Утверждение 2 — (color{green}{smalltext{Верно }})
3) (p=nkT) где (n) — концентрация молекул. Из этой формулы видно, что концентрация не изменилась.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) По пункту 1, утверждение 4 — (color{green}{smalltext{Верно }})
5) Плотность газа: [rho=dfrac{pmu}{RT}] где (mu) — молярная масса газа. Давление, молярная масса и температура газа не изменились, поэтому плотность тоже не изменится.
Утверждение 5 — (color{red}{smalltext{Неверно }})
Ответ: 24
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления (р) газа от объёма (V). Количество вещества газа при этом не меняется. 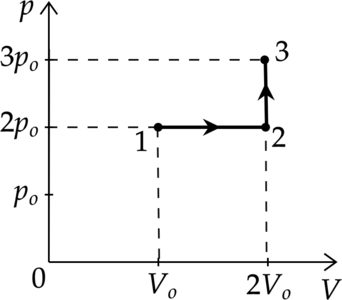
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике, и укажите их номера.
1) Абсолютная температура газа максимальна в состоянии 1.
2) В процессе 1-2 абсолютная температура газа изобарно увеличилась в 2 раза.
3) В процессе 2-3 абсолютная температура газа изохорно увеличилась в 1,5 раза.
4) Плотность газа минимальна в состоянии 1.
5) В ходе процесса 1-2-3 средняя квадратическая скорость теплового движения молекул газа увеличивается в 6 раз.
1) Уравнение состояния газа: [pV=nu RT] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Температура максимальна там, где максимально произведение (pV), поэтому из графика видно, что (T_1 — min), (T_3 — max)
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Процесс 1-2 — изобарное расширение ((Vsim T)). Объем увеличился в 2 раза, то есть температура тоже увеличилась в 2 раза.
Утверждение 2 — (color{green}{smalltext{Верно }})
3) Процесс 2-3 — изохорное нагревание. (V=const), следовательно (psim T) Давление увеличивается в 1,5 раза, то есть температура тоже увеличивается в 1,5 раза.
Утверждение 3 — (color{green}{smalltext{Верно }})
4) В точке 1 — объем минимален, следоваельно, плотность там максимальна. Утверждение 4 — (color{red}{smalltext{Неверно }})
5) [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] [v^2sim T] [vsim sqrt{T}] Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в (sqrt{3}) раз
Утверждение 5 —(color{red}{smalltext{Неверно }})
Ответ: 23
В ходе адиабатного процесса внутренняя энергия 2 моль разреженного аргона уменьшилась.
Выберите из предложенного перечня два верных утверждения, верно описывающие данный процесс, и укажите их номера.
1) Температура газа в ходе процесса увеличилась.
2) В ходе процесса газ расширился, совершив работу.
3) Давление газа в течение всего процесса остаётся неизменным.
4) Концентрация молекул газа в ходе процесса уменьшилась.
5) Объём газа в ходе процесса уменьшается.
1) Внутренняя энергия: [U=dfrac{i}{2}nu RT] где (nu) — количество вещества, (T) — температура в Кельвинах (i) — количество степеней свободы газа. Внутренняя энергия уменьшается, следовательно, температура уменьшается.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. Процесс — адиабатический, то есть (Q=0) (A=-Delta U), (Delta U<0), значит (-Delta U>0), (A>0)
Утверждение 2 — (color{green}{smalltext{Верно }})
3) При адиабатном процессе давление изменяется
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) (A>0), то есть газ расширяется, объем увеличивается. Концентрация молекул: [n=dfrac{N}{V}] где (N) — количество молекул, (V) — объем, занимаемый молекулами. Знаменатель увеличивается, значит, концентрация уменьшается.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) (A>0), то есть газ расширяется, объем увеличивается.
Утверждение 5 —(color{red}{smalltext{Неверно }})
Ответ: 24
При переводе одноатомного идеального газа из состояния 1 в состояние 2 давление p пропорционально концентрации его молекул n (см. рисунок). Масса газа в процессе остаётся постоянной. 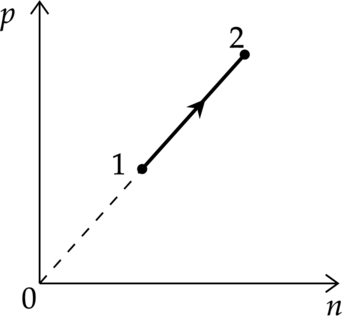
Из приведённого ниже списка выберите два правильных утверждения, характеризующих процесс 1-2.
1) Абсолютная температура газа увеличивается.
2) Происходит изотермическое расширение газа.
3) Среднеквадратическая скорость теплового движения молекул газа увеличивается.
4) Плотность газа увеличивается.
5) Средняя кинетическая энергия теплового движения молекул газа остаётся неизменной.
1) [p=nkT] где (n) — концентрация молекул, (T) — температура в Кельвинах, (p) — давление газа. Из графика видно, что (psim n), значит, процесс происходит при постоянной температуре ((T=const))
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Концентрация в процессе увеличивается [n=dfrac{N}{V}] где (N) — количество молекул, (V) — объем, занимаемый молекулами. Из этого следут, что объем в процессе уменьшался, т.е. газ изотермически сжимают
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Кинетическая энергия находится по формуле: [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] [v^2sim T] Температура не меняется, следовательно, средняя квадратичная скорость тоже не меняется
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Плотность равна: [rho=dfrac{m}{V}] Объем в этом процессе уменьшается, масса не изменяется, следовательно, плотность увеличивается.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) (T=const) [E_{k}=dfrac{3}{2}kT] [E_{k}=const]
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45

Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Перейти к контенту
Десятичные приставки
| Наименование | Обозначение | Множитель |
| гига | Г | 109 |
| мега | М | 106 |
| кило | к | 103 |
| деци | д | 10–1 |
| санти | с | 10–2 |
| милли | м | 10–3 |
| микро | мк | 10–6 |
| нано | н | 10–9 |
| пико | п | 10–12 |
Физические постоянные (константы)
| число π | π = 3,14 |
| ускорение свободного падения | g = 10 м/с2 |
| гравитационная постоянная | G = 6,7·10–11 Н·м2/кг2 |
| газовая постоянная | R = 8,31 Дж/(моль·К) |
| постоянная Больцмана | k = 1,38·10–23 Дж/К |
| постоянная Авогадро | NA = 6,02·1023 1/моль |
| скорость света в вакууме | с = 3·108 м/с |
| коэффициент пропорциональности в законе Кулона | k = 1/(4πε0) = 9·109 Н·м2/Кл2 |
| модуль заряд электрона | e = 1,6·10-19 Кл |
| масса электрона | me = 9,1·10–31 кг |
| масса протона | mp = 1,67·10–27 кг |
| постоянная Планка | h = 6,62·10-34 Дж·с |
| радиус Солнца | 6,96·108 м |
| температура поверхности Солнца | T = 6000 K |
| радиус Земли | 6370 км |
Соотношение между различными единицами измерения
| температура | 0 К = –273 0С |
| атомная единица массы | 1 а.е.м. = 1,66·10–27 кг |
| 1 атомная единица массы эквивалентна | 931,5 МэВ |
| 1 электронвольт | 1 эВ = 1,6·10-19 Дж |
| 1 астрономическая единица | 1 а.е. ≈ 150 000 000 км |
| 1 световой год | 1 св. год ≈ 9,46·1015 м |
| 1 парсек | 1 пк ≈ 3,26 св. года |
Масса частиц
| электрона | 9,1·10–31кг ≈ 5,5·10–4 а.е.м. |
| протона | 1,673·10–27 кг ≈ 1,007 а.е.м. |
| нейтрона | 1,675·10–27 кг ≈ 1,008 а.е.м. |
Плотность
| воды | 1000 кг/м3 |
| древесины (сосна) | 400 кг/м3 |
| керосина | 800 кг/м3 |
| подсолнечного масла | 900 кг/м3 |
| алюминия | 2700 кг/м3 |
| железа | 7800 кг/м3 |
| ртути | 13 600 кг/м3 |
Удельная теплоёмкость
| воды | 4,2·10 3 Дж/(кг·К) |
| льда | 2,1·10 3 Дж/(кг·К) |
| железа | 460 Дж/(кг·К) |
| свинца | 130 Дж/(кг·К) |
| алюминия | 900 Дж/(кг·К) |
| меди | 380 Дж/(кг·К) |
| чугуна | 500 Дж/(кг·К) |
Удельная теплота
| парообразования воды | 2,3·10 6 Дж/кг |
| плавления свинца | 2,5·10 4 Дж/кг |
| плавления льда | 3,3·10 5 Дж/кг |
Нормальные условия:
| давление | 105 Па |
| температура | 00 C |
Молярная маcса молекул
| азота | 28·10–3 кг/моль |
| аргона | 40·10–3 кг/моль |
| водорода | 2·10–3 кг/моль |
| воздуха | 29·10–3 кг/моль |
| воды | 18·10–3 кг/моль |
| гелия | 4·10–3 кг/моль |
| кислорода | 32·10–3 кг/моль |
| лития | 6·10–3 кг/моль |
| неона | 20·10–3 кг/моль |
| углекислого газа | 44·10–3 кг/моль |
Справочные данные из демоверсии, которые могут понадобиться вам при выполнении работы.
Десятичные приставки
Константы
Соотношения между различными единицами
Масса частиц
Астрономические величины
Плотность
Удельная теплоёмкость
Удельная теплота
Нормальные условия
Молярная маcса
→ sp-fizika.pdf
→ Другой справочник с формулами.
→ Основные формулы по физике.
→ 180 формул по физике на одном листе.
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
Справочные материалы ЕГЭ по физике 2022-2023
Десятичные приставки
Наименование — Обозначение — Множитель
- гига — Г — 109
- мега — М — 106
- кило — к — 103
- гекто — г — 102
- деци — д — 10–1
- санти — с — 10–2
- милли — м — 10–3
- микро — мк — 10–6
- нано — н — 10–9
- пико — п — 10–12
Физические постоянные (константы)
- число π: π = 3,14
- ускорение свободного падения: g = 10 м/с2
- гравитационная постоянная: G = 6,7·10–11 Н·м2/кг2
- универсальная газовая постоянная: R = 8,31 Дж/(моль·К)
- постоянная Больцмана: k = 1,38·10–23 Дж/К
- постоянная Авогадро: NA = 6·1023 1/моль
- скорость света в вакууме: с = 3·108 м/с
- коэффициент пропорциональности в законе Кулона: k = 1/(4πε0) = 9·109 Н·м2/Кл2
- модуль заряд электрона (элементарный электрический заряд): e = 1,6·10−19 Кл
- постоянная Планка: h = 6,6·10-34 Дж·с
Соотношение между различными единицами измерения
- температура: 0 К = –273 0С
- атомная единица массы: 1 а.е.м. = 1,66·10–27 кг
- 1 атомная единица массы эквивалентна: 931,5 МэВ
- 1 электронвольт: 1 эВ = 1,6·10−19 Дж
Масса частиц
- электрона — 9,1·10–31 кг ≈ 5,5·10–4 а.е.м.
- протона — 1,673·10–27 кг ≈ 1,007 а.е.м.
- нейтрона — 1,675·10–27 кг ≈ 1,008 а.е.м.
Плотность
- воды — 1000 кг/м3
- древесины (сосна) — 400 кг/м3
- керосина — 800 кг/м3
- подсолнечного масла — 900 кг/м3
- алюминия — 2700 кг/м3
- железа — 7800 кг/м3
- ртути — 13 600 кг/м3
Удельная теплоёмкость
- воды — 4,2·103 Дж/(кг·К)
- льда — 2,1·103 Дж/(кг·К)
- железа — 460 Дж/(кг·К)
- свинца — 130 Дж/(кг·К)
- алюминия — 900 Дж/(кг·К)
- меди — 380 Дж/(кг·К)
- чугуна — 500 Дж/(кг·К)
Удельная теплота
- парообразования воды — 2,3·106 Дж/кг
- плавления свинца — 2,5·104 Дж/кг
- плавления льда — 3,3·105 Дж/кг
Нормальные условия
- давление: 105 Па
- температура: 0 °С
Молярная масса молекул
- азота: 28·10–3 кг/моль
- аргона: 40·10–3 кг/моль
- водорода: 2·10–3 кг/моль
- воздуха: 29·10–3 кг/моль
- воды: 18·10–3 кг/моль
- гелия: 4·10–3 кг/моль
- кислорода: 32·10–3 кг/моль
- лития: 6·10–3 кг/моль
- неона: 20·10–3 кг/моль
- углекислого газа: 44·10–3 кг/моль
- Взрослым: Skillbox, Хекслет, Eduson, XYZ, GB, Яндекс, Otus, SkillFactory.
- 8-11 класс: Умскул, Лектариум, Годограф, Знанио.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- Английский: Инглекс, Puzzle, Novakid.
20.1797 g/mol
The molar mass and molecular weight of Ne is 20.18.
| Element | Symbol | Atomic Mass | # of Atoms | Mass Percent |
|---|---|---|---|---|
| Neon | Ne | 20.1797 g/mol | 1 | 100% |
Neon Element Mass PercentNeon20.1797gNeon20.1797g
Ne # of AtomsNeon1Neon1
Finding Molar Mass
Read our article on how to calculate molar mass.
You can also ask for help in our chat or forums.
Find the Molar Mass of Neon, Ne Step-by-Step
There are 4 easy steps to find the molar mass of Ne based on its chemical formula.
1. Count The Number of Each Atom
The first step to finding the molar mass of Neon is to count the number of each atom present in a single molecule using the chemical formula, Ne:
| Element | Number of Atoms |
|---|---|
| Ne (Neon) | 1 |
2. Find Atomic Mass of Each Element
Next, using the periodic table, find the atomic mass in g/mol of each element (the molar mass of an element is equal to its atomic mass):
| Molar Mass (g/mol) | |
|---|---|
| Ne (Neon) | 20.1797 |
3. Compute Mass of Each Element
Multiply the number of atoms by the atomic weight of each element found in steps 1 and 2 to get the mass of each element in Ne:
| Molar Mass (g/mol) | |
|---|---|
| Ne (Neon) | 1 × 20.1797 = 20.1797 |
4. Sum Each Element’s Mass
Finally, add together the total mass of each element to get the molar mass of Ne:
20.1797 g/mol = 20.1797 g/mol