В резервуаре находится 20 кг азота при температуре 300 К и давлении Чему равен объём резервуара? Ответ выразите в кубических метрах с точностью до десятых.
Спрятать решение
Решение.
Азот в резервуаре можно считать идеальным газом, который подчиняется уравнению состояния Клапейрона — Менделеева: где M — молярная масса газа. Следовательно, объём резервуара равен
Ответ: 17,8.
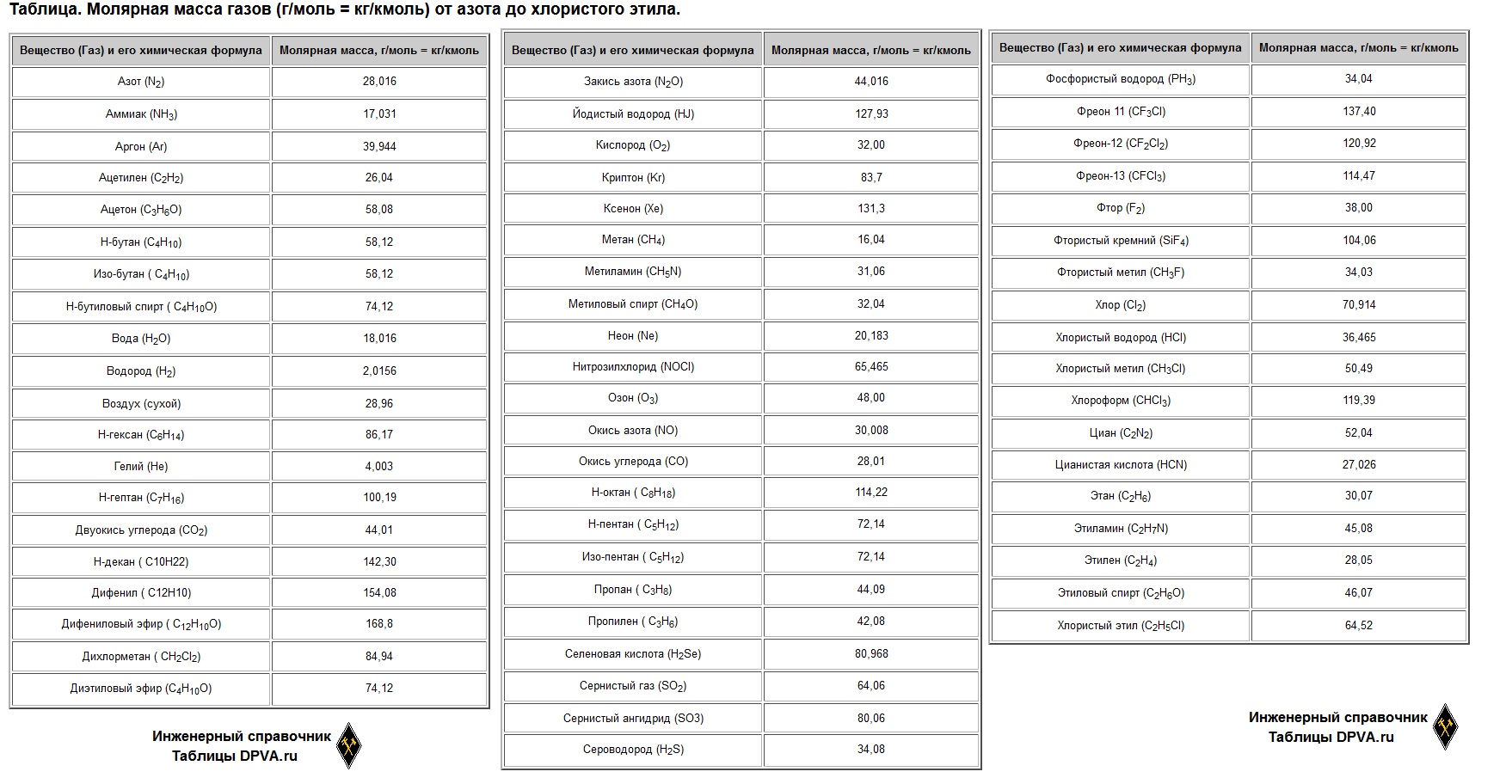
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H6O) |
58,08 |
|
Н-бутан (C4H10) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (H2) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10H22) |
142,30 |
|
Дифенил ( C12H10) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O2) |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
|
Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2H4) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
Хлористый этил (C2H5Cl) |
64,52 |
← Молярная и молекулярная масса
- Относительная молекулярная масса N: 14.0067
- Молярная масса N: 14.0067 г/моль (0.01401 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| N (азот) | 1 | 14.0067 | 14.0067 |
| 14.0067 |
Расчёт молярной и относительной молекулярной массы N
- Mr[N] = Ar[N] = 14.0067 = 14.0067
- Молярная масса (в кг/моль) = Mr[N] : 1000 = 14.0067 : 1000 = 0.01401 кг/моль
Электронная конфигурация атома азота
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH6OSi [62.14324]
C6H18N2Si [146.30602]
Калькулятор молекулярной массы

Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
09.03.2023
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Азот (N2) | 28,016 |
| Аммиак (NH3) | 17,031 |
| Аргон (Ar) | 39,944 |
| Ацетилен (C2H2) | 26,04 |
| Ацетон (C3H6O) | 58,08 |
| Н-бутан (C4H10) | 58,12 |
| Изо-бутан ( C4H10) | 58,12 |
| Н-бутиловый спирт ( C4H10O) | 74,12 |
| Вода (H2O) | 18,016 |
| Водород (H2) | 2,0156 |
| Воздух (сухой) | 28,96 |
| Н-гексан (C6H14) | 86,17 |
| Гелий (He) | 4,003 |
| Н-гептан (C7H16) | 100,19 |
| Двуокись углерода (CO2) | 44,01 |
| Н-декан ( C10H22) | 142,30 |
| Дифенил ( C12H10) | 154,08 |
| Дифениловый эфир ( C12H10O) | 168,8 |
| Дихлорметан ( CH2Cl2) | 84,94 |
| Диэтиловый эфир (C4H10O) | 74,12 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Закись азота (N2O) | 44,016 |
| Йодистый водород (HJ) | 127,93 |
| Кислород (O2) | 32,00 |
| Криптон (Kr) | 83,7 |
| Ксенон (Xe) | 131,3 |
| Метан (CH4) | 16,04 |
| Метиламин (CH5N) | 31,06 |
| Метиловый спирт (CH4O) | 32,04 |
| Неон (Ne) | 20,183 |
| Нитрозилхлорид (NOCl) | 65,465 |
| Озон (O3) | 48,00 |
| Окись азота (NO) | 30,008 |
| Окись углерода (CO) | 28,01 |
| Н-октан ( C8H18) | 114,22 |
| Н-пентан ( C5H12) | 72,14 |
| Изо-пентан ( C5H12) | 72,14 |
| Пропан ( C3H8) | 44,09 |
| Пропилен ( C3H6) | 42,08 |
| Селеновая кислота (H2Se) | 80,968 |
| Сернистый газ (SO2) | 64,06 |
| Сернистый ангидрид (SO3) | 80,06 |
| Сероводород (H2S) | 34,08 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Фосфористый водород (PH3) | 34,04 |
| Фреон 11 (CF3CI) | 137,40 |
| Фреон-12 (CF2CI2) | 120,92 |
| Фреон-13 (CFCI3) | 114,47 |
| Фтор (F2) | 38,00 |
| Фтористый кремний (SiF4) | 104,06 |
| Фтористый метил (CH3F) | 34,03 |
| Хлор (Cl2) | 70,914 |
| Хлористый водород (HCl) | 36,465 |
| Хлористый метил (CH3Cl) | 50,49 |
| Хлороформ (CHCl3) | 119,39 |
| Циан (C2N2) | 52,04 |
| Цианистая кислота (HCN) | 27,026 |
| Этан (C2H6) | 30,07 |
| Этиламин (C2H7N) | 45,08 |
| Этилен (C2H4) | 28,05 |
| Этиловый спирт (C2H6O) | 46,07 |
| Хлористый этил (C2H5Cl) | 64,52 |