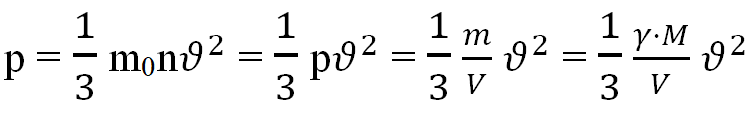В резервуаре находится 20 кг азота при температуре 300 К и давлении Чему равен объём резервуара? Ответ выразите в кубических метрах с точностью до десятых.
Спрятать решение
Решение.
Азот в резервуаре можно считать идеальным газом, который подчиняется уравнению состояния Клапейрона — Менделеева: где M — молярная масса газа. Следовательно, объём резервуара равен
Ответ: 17,8.
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H6O) |
58,08 |
|
Н-бутан (C4H10) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (H2) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10H22) |
142,30 |
|
Дифенил ( C12H10) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O2) |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
|
Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2H4) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
Хлористый этил (C2H5Cl) |
64,52 |
Продолжаем разбирать задания из ЕГЭ по физике прошлых лет. Сегодня обратим внимание на №26, термодинамика.
Задача №1
В закрытом сосуде объёмом 20 литров находится 0,5 моль азота. Давление газа в сосуде равно 100 кПа. Чему равна среднеквадратичная скорость молекул этого газа? Ответ дайте в м/с и округлите до целого числа.
Решение
Запишем основное уравнение МКТ газа:
Молярная масса азота равна M = 0,028 кг/моль. Найдем среднеквадратичную скорость молекул газа:
=
Подставим числовые значения и вычислим:
=
655 м/с
Ответ: 655.
Задача №2
В закрытом сосуде объёмом 20 литров находится 0,2 моль кислорода. Давление газа в сосуде равно 100 кПа. Чему равна среднеквадратичная скорость молекул этого газа? Ответ округлите до целого числа.
Решение
Запишем основное уравнение МКТ газа:
Молярная масса кислорода равна M = 0,032 кг/моль. Найдем среднеквадратичная скорость молекул газа:
=
Подставим числовые значения и вычислим:
=
968 м/с
Ответ: 968.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
← Молярная и молекулярная масса
- Относительная молекулярная масса N: 14.0067
- Молярная масса N: 14.0067 г/моль (0.01401 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| N (азот) | 1 | 14.0067 | 14.0067 |
| 14.0067 |
Расчёт молярной и относительной молекулярной массы N
- Mr[N] = Ar[N] = 14.0067 = 14.0067
- Молярная масса (в кг/моль) = Mr[N] : 1000 = 14.0067 : 1000 = 0.01401 кг/моль
Электронная конфигурация атома азота
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH6OSi [62.14324]
C6H18N2Si [146.30602]
Калькулятор молекулярной массы

Содержание
Задание 26. В баллоне находятся 20 кг азота при температуре 300 К и давлении 105 Па. Каков объём баллона? Ответ округлите до целых.
Решение задачи
Запишем уравнение Менделеева-Клапейрона:
Где µ — молярная масса азота 28 г/моль, R — универсальная газовая постоянная 8,31 Дж/моль * К.
Из уравнения выразим объём баллона:
Подставим числовые значения в формулу.
V = 20 * 8,31 * 300 / 0,028 * 100000 ≈ 18 м3.
Ответ к задаче
Ответ: 18 м3.
Просмотров: 6 854
Читайте также: Фотокатод облучают светом с длиной волны 300 нм. Красная граница фотоэффекта фотокатода 450 нм. Вычислите запирающее напряжение U между анодом и катодом
30. Молекулярная физика (расчетная задача)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
В двух сосудах объемами (V) находились углекислый газ и азот, их плотности составляли (rho_1) = 44(cdot) 10(^{-3}) кг/м(^3) и (rho_2) = 56(cdot) 10(^{-3}) кг/м(^3), затем их слили в сосуд объемом (V). Найдите установивишееся давление в сосуде, если температура в нем (T) = 300 К.
Запишем уравнение Клапейрона–Менделеева: [pV=nu R T,] где (p) — давление газа, (V) — объем газа, (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (T) — температура газа в Кельвинах.
Количество вещества можно найти по формуле: [nu=dfrac{m}{mu}, ; ; ; ; (1)] где (m) — масса газа, (mu) — молярная масса газа.
Выразим давление из уравнения Клапейрона–Менделеева: [p=dfrac{nu R T}{V},; ; ; ; (2)] По закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов: [p=p_1+p_2, ; ; ; ; (3)] где (p_1) и (p_2) — давления углекислого газа и азота соответственно, (p) — общее давление смеси.
Подставим (1), (2) в (3) с учетом того, что объемы газов и их температуры равны (так как находятся в одном сосуде): [p=dfrac{m_1 R T}{mu_1 V}+dfrac{m_2 R T}{mu_2 V}] Так как (dfrac{m}{V}) это плотность, то суммарное давление смеси: [displaystyle p=dfrac{rho_1 R T}{mu_1 }+dfrac{rho_2 R T}{mu_2 }=RTleft(dfrac{rho_1}{mu_1}+dfrac{rho_2}{mu_2} right)] Найдем общее давление смеси: [p=8,31 text{ Дж/(моль$cdot$ К)}cdot 300 text{ К}cdot left(dfrac{56cdot 10^{-3} text { кг/м$^3$} }{28cdot 10^{-3}text{ кг/моль}}+dfrac{44cdot 10^{-3} text { кг/м$^3$} }{44cdot 10^{-3}text{ кг/моль}}right)=7479text{ Па}]
Ответ: 7479 Па
Баллон, содержащий (m_1) =1 кг азота, при испытании на прочность взорвался при температуре (T_1) = 600 К. Какую массу водорода (m_2) можно было бы хранить в таком баллоне при температуре (T_2 ) = 300 К , если баллон сможет выдержать нагрузку в 5 раз больше? Молярная масса азота (Mr_1) = 28 г/моль, водорода (Mr_2) = 2 г/моль.
Запишем уравнение Клапейрона – Менделеева: [pV=nu R T,] где (p) — давление газа, (V) — объем газа, (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (T) — температура газа в Кельвинах.
Количество вещества можно найти по формуле: [nu=dfrac{m}{Mr}, ; ; ; ; (1)] где (m) — масса газа, (Mr) — молярная масса газа.
Выразим давление из уравнения Клапейрона – Менделеева с учетом (1): [p=dfrac{m R T}{Mr V}, quad (2)] Так как запас прочности во втором случае в 5 раз больше, то и давление, которое может выдержать сосуд в 5 раз больше, а значит: [dfrac{p_2}{p_1}=5 ; ; ; Rightarrow ; ; ; p_2=5p_1] Перепишем данное уравнение с учетом (2): [dfrac{m_2 R T_2}{Mr_2 V}=5cdotdfrac{m_1 R T_1}{Mr_1 V}] Выразим искамую массу (m_2) и найдем ее: [m_2=dfrac{5 m_1 T_1 Mr_2 }{Mr_1 T_2}] [m_2 =dfrac{5 cdot 1 text{ кг}cdot 600 text{ К} cdot 2cdot 10^{-3}text{ кг/моль}}{ 28cdot 10^{-3} text{ кг/моль} cdot 300 text{ К}} approx 0,7 text{ кг}]
Ответ: 0,7 кг
В горизонтальной трубке запаянной с одного конца, помещена ртуть длина столбика которой (h) = 7,5 см. Столбик ртути отделяет воздух в трубке от атмосферы. Трубку расположили вертикально запаянным концом вниз и нагрели на (Delta T) = 50 К. При этом объем, занимаемый воздухом, не изменился. Давление атмосферы в лаборатории — 750 мм рт. ст. Какова температура воздуха в лаборатории?
Давление воздуха будет уравновешивать давление окружающей среды (p_o) и давление столбика ртути (p_h), то есть: [p=p_o+p_h=rho g H + rho g h] [p = rho g (H+h), ; ; ; ; ; (1)] где (rho) — плотность ртути, (g) — ускорение свободного падения, (H) — столб ртути (750 мм = 75 см).
Так как объем воздуха не изменился, то нагревание изохорное, а значит оно подчиняется закону Шарля: [dfrac{p_o}{T_o}=dfrac{p}{T} ; ; ; Rightarrow ; ; ; dfrac{T}{T_o}=dfrac{p}{p_o} ; ; ; ; (2)] Так как происходит нагревание на (Delta T), то: [T=T_o+Delta T ; ; ; ; ; (3)] Подставив (1) и (3) в (2), получим: [dfrac{T_o +Delta T}{T_o}=dfrac{rho g (H+h)}{rho g H} ; ; ; Rightarrow ; ; ; 1+dfrac{Delta T}{T_o}=dfrac{H+h}{H}=1+dfrac{h}{H}] [T_o=dfrac{Hcdot Delta T}{h}] [T_o = dfrac{75text{ см}cdot 50text{ К}}{7,5 text{ см}}=500text{ К}]
Ответ: 500
Два моля идеального газа сначала изотермически расширяются. При этом его объём увеличивается вдвое: (V_2 = 2V_1). Затем газ нагревается при постоянном объёме до первоначального давления (p_3 = p_1). Далее происходит изобарическое расширение газа до объёма, втрое превышающего начальный объём: (V_4 = 3V_1). Температура и давление газа в начальном состоянии 1 равны (t_1) = 7 (^circ)C и (p_1 ) =10(^5) Па , соответственно. Определите значения неизвестных температур, объёмов и давлений газа в состояниях 1, 2, 3 и 4. В ответ дайте давления, температуры и объемы для каждого состояния в порядке 1,2,3,4.
Переведём градусы Цельсия в градусы Кельвина 7(^circ)С = 280 К
Процессы:
1-2 — изотермическое расширение
2-3 — изохорное нагревание
3-4 — изобарическое расширение
Неизвестные параметры будем находить используя закон Менделеева–Клапейрона [pV=nu RT,] а также законы изопроцессов (так как количество вещества остается постоянным, то эти законы применимы):
изобарный — (Vsim T; ; ; ; ; ; ; ; ; ; ; ; (1))
изохорный — (psim T; ; ; ; ; ; ; ; ; ; ; ; ;(2) )
изотермический — (psim dfrac{1}{V} ; ; ; ; (3))
где (nu) — количество вещества газа, (R) — универсальная газовая постоянная, (T) — абсолютная температура газа.
Состояние 1:
Выразим из уравнения Менделеева – Клапейрона объем газа (для состояния 1): [V_1=dfrac{nu R T_1}{p_1}] [V_1=dfrac{2text{ моль}cdot8,31text{ Дж/(моль$cdot$К)}cdot280text{ К}}{10^5text{ Па}}approx0,0465 text{ м$^3$}] Состояние 2:
Так как процесс 1-2 — изотермический, то (T_1) = (T_2) = 280 К
По условию (V_2=2V_1 ; ; ; Rightarrow ; ; ; V_2 =) 0,093 м(^3)
По уравнению (3) при увеличении объема в два раза давление уменьшится в 2 раза, следовательно, давление в состоянии 2 равно: (p_2=dfrac{p_1}{2}=0,5cdot 10^5text{ Па})
Состояние 3:
Так как процесс 2-3 — изохорный, то (V_3=V_2=) 0,093 м(^3)
По условию (p_3=p_1=) 10(^5) Па
Из уравнения Менделеева – Клапейрона выразим температуру газа (для состояния 3): [T_3=dfrac{p_3V_3}{nu R}] [T_3=dfrac{10^5text{ Па}cdot0,093text{ м$^3$}}{2text{ моль}cdot8,31text{ Дж/(моль$cdot$К)}}approx560text{ К}] Состояние 4:
Так как процесс изобарный, то (p_4=p_3=p_1) = 10(^5) Па
По условию (V_4=3V_1 ; ; ; Rightarrow ; ; ; V_4=) 3(cdot) 0,0465 м(^3) = 0,1395 м(^3)
Температура газа в состоянии 4 равна: [T_4=dfrac{p_4V_4}{nu R}] [T_4=dfrac{10^5text{ Па}cdot0,1395text{ м$^3$}}{2text{ моль}cdot8,31text{ Дж/(моль$cdot$К)}}=840text{ К}]
состояние 1: (p_1) = 10(^5) Па, (T_1) = 280 К, (V_1) = 0,0465 м(^3)
состояние 2: (p_2) = 0,5(cdot)10(^5) Па, (T_2) = 280 К, (V_2) = 0,093 м(^3)
состояние 3: (p_3) = 10(^5) Па, (T_3) = 560 К, (V_3) = 0,093 м(^3)
состояние 4: (p_4) = 10(^5) Па, (T_4) = 840 К, (V_4) = 0,1395 м(^3)
Ответ: p₁ = 10⁵ Па, T₁ = 280 К, V₁ = 0,0465 м³
p₂ = 0,5⋅10⁵ Па, T₂ = 280 К, V₂ = 0,093 м³
p₃ = 10⁵ Па, T₃ = 560 К, V₃ = 0,093 м³
p₄ = 10⁵ Па, T₄ = 840 К, V₄ = 0,1395 м³

Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ
Курс Глицин. Любовь, друзья, спорт и подготовка к ЕГЭ