Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
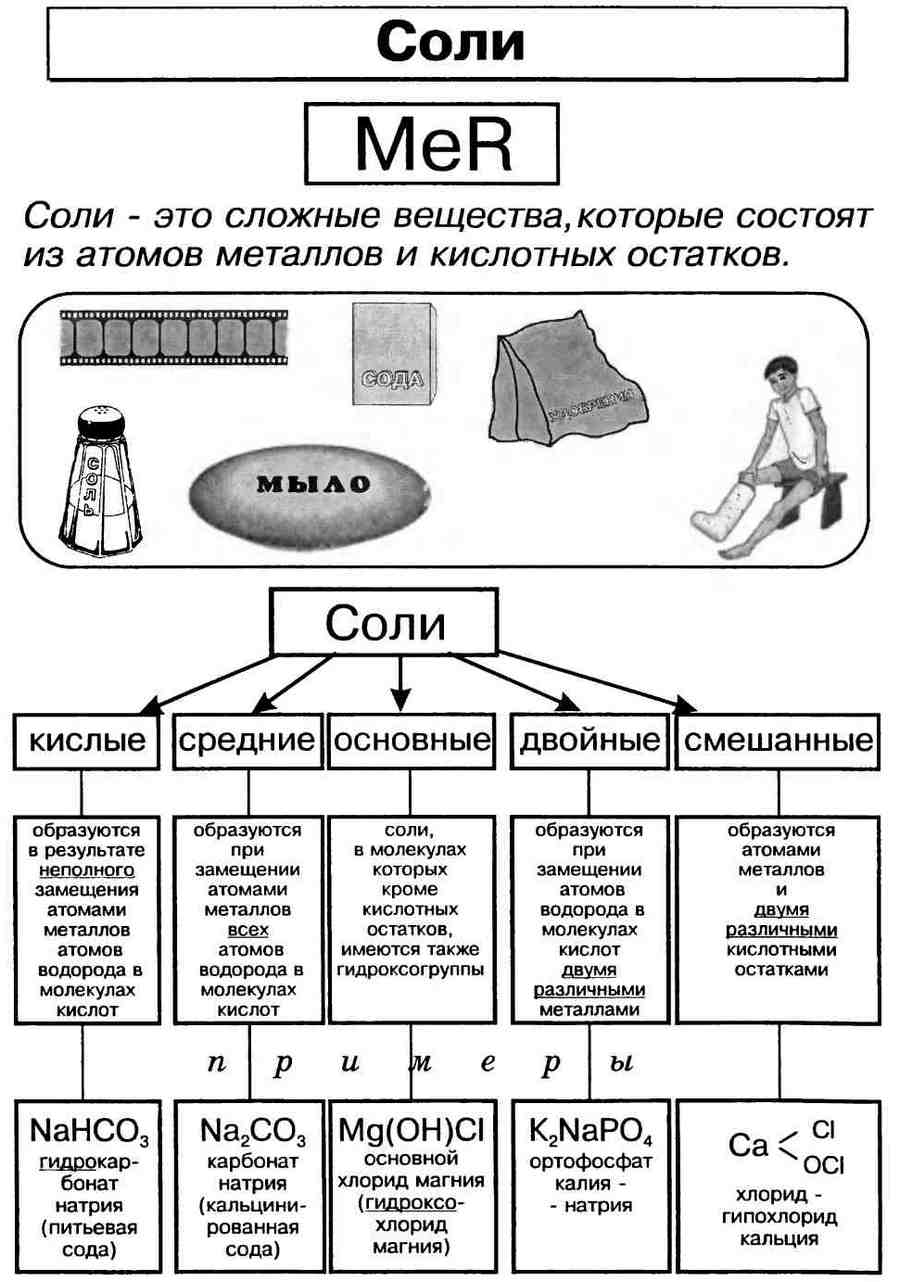
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
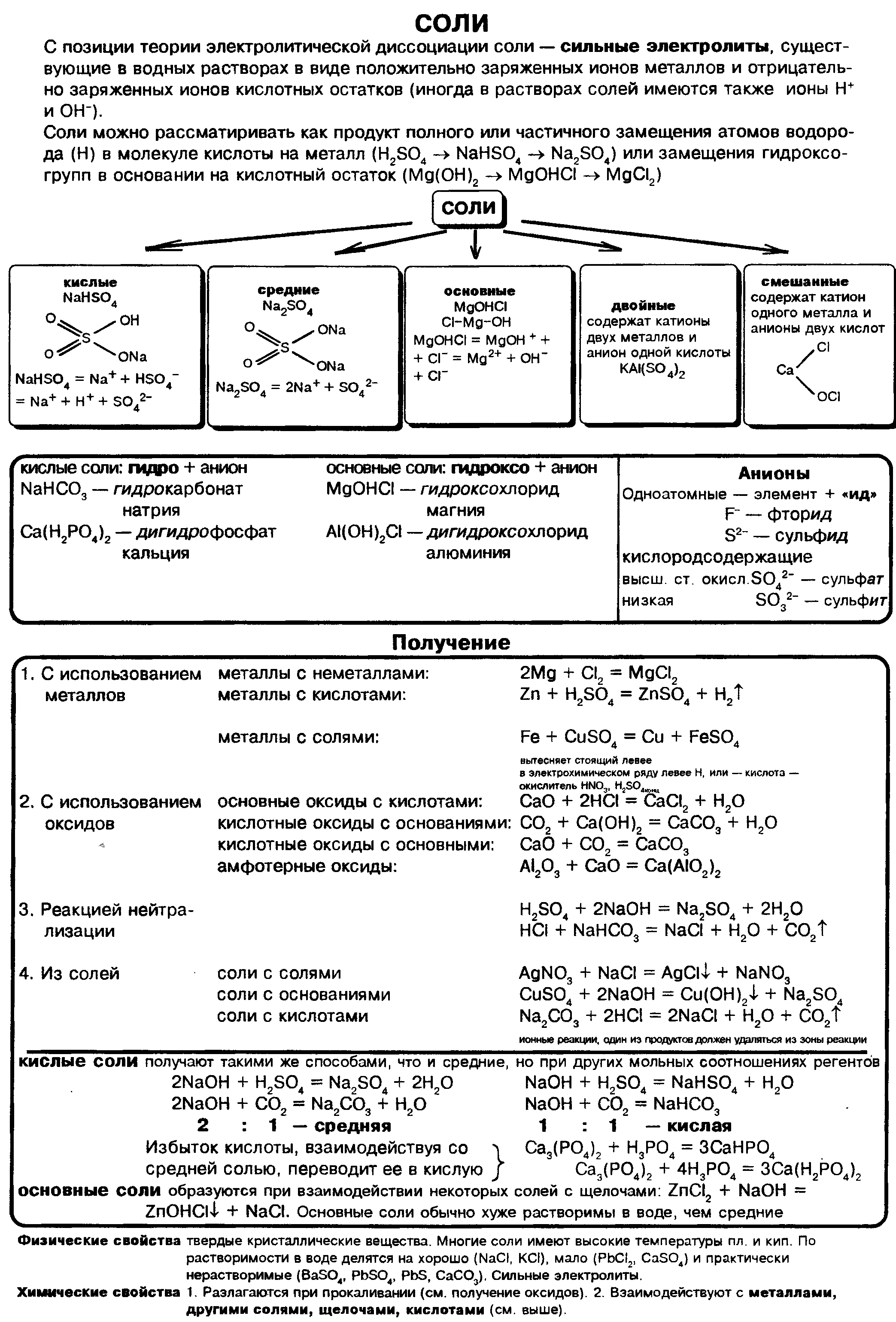
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K2CO3 + H2O
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Все нитраты:
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20
8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите «Нет».
СРЕДНИЕ СОЛИ
Катионы металла +анионы кислотного остатка
Названия средних солей состоят из двух частей: названия аниона (кислотного остатка) в именительном падеже и катиона в родительном.
Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
Например,
CuSO4 – сульфат меди (II);
NaCl – хлорид натрия.
КИСЛЫЕ СОЛИ
Катионы металла + катионы водорода + анионы кислотного остатка
Названия кислых солей образуются добавлением к аниону приставки гидро-, и, если необходимо, то с соответствующим числительным.
Например,
NaHSO4 – гидросульфат натрия;
KH2PO4 – дигидрофосфат калия.
ОСНОВНЫЕ СОЛИ
Катионы металла + анионы гидроксильных групп +анионы кислотного остатка
Названия основных солей образуются добавлением к аниону приставки гидроксо-, и, если необходимо, то с соответствующим числительным.
Например,
AlOHSO4 – гидроксосульфат алюминия;
Fe(OH)2Cl – дигидроксохлорид железа (III).
ДВОЙНЫЕ СОЛИ
Содержат два химически разных катиона;
например: CaMg(CO3)2, KAl(SO4)2, Fe(NH4)2(SO4)2.
Названия двойных солей состоят из двух частей: названия аниона в именительном падеже и катионов в родительном в алфавитном порядке.
Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
Например,
KAl(SO4)2 – сульфат алюминия – калия;
(NH4)2Fe(SO4)2 – сульфат железа (II) – аммония.
СМЕШАННЫЕ СОЛИ
Содержат два химически разных аниона; например: Mg₂SO₄CO3, K₃ClSO4, FeNO₃SO3.
Названия смешанных солей состоят из двух частей: названия 2 анионов в именительном падеже и катиона в родительном падеже.
Число катионов и анионов, как правило, не указывается. Если металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
КОМПЛЕКСНЫЕ СОЛИ
Содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
например:
K4[Fe(CN)6]- гексацианоферрат (II) калия (или желтая кровяная соль),
K3[Fe(CN)6] — гексацианоферрат (III) калия (или красная кровяная соль).
При названии соединений с комплексным анионом комплексообразователь называют по латински, добавляя суффикс -ат.
Валентность комплексообразователя указывают римскими цифрами в скобках после названия комплексного аниона.
Число лигандов обозначают с помощью греческих числительных: 1 – моно-, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Название катиона указывают в родительном падеже.
Например,
Na[Al(OH)4] – тетрагидроксоалюминат натрия;
K3[Cu(CN)4] –
(NH4)2[Hg(NCS)4] – тетрароданомеркурат (II) аммония.
Наиболее часто встречаемые анионы
CN- — циано;
CO32- — карбонато;
OH- — гидроксо;
Cl- — хлоро;
F- — фторо;
I- — иодо;
CH3COO- — ацетато;
CNS- — родано и т.д.
Некоторые нейтральные лиганды имеют специальные названия: CO — карбонил; H2O — аква; NH3 — аммин.
КРИСТАЛЛОГИДРАТЫ
кристаллические гидраты определенного состава (Na2CO3× 10H2O – декагидрат карбоната натрия).
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
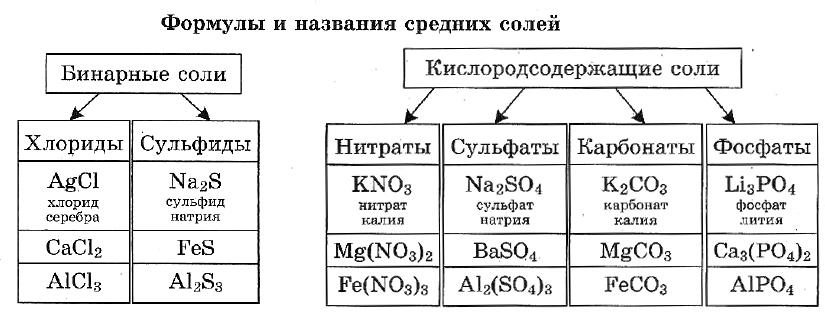
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
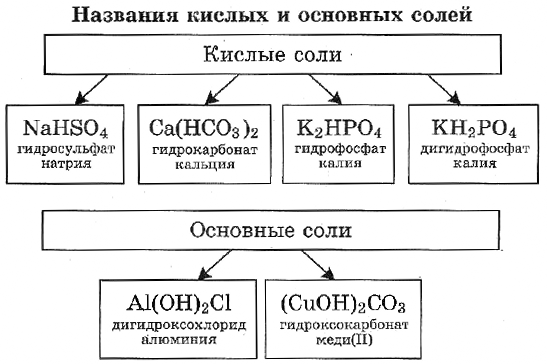
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
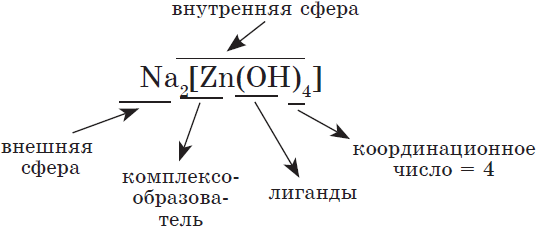
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Соли
Химия 11 класс. Ключевые слова конспекта: Соли. Классификация солей. Жёсткость воды и способы её устранения. Общие химические свойства солей.
Понятие о соли.
Генетические ряды металла и неметалла завершает класс солей:
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете? Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са2+ + 2НСО3–
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.
Умягчение жёсткой воды проводят разными способами:
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
Средняя, или нормальная, соль образуется в результате полного замещения катионов водорода в кислоте на катионы металла.
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Названия солей с центральным атомом в промежуточной степени окисления — S+4, N+3 — содержат суффикс «-ит»: Na2SO3 — сульфит натрия, KNO2 — нитрит калия. Это соли сернистой и азотистой кислот.
Некоторые соли имеют свои традиционные (тривиальные) названия. Так, ряд солей серной кислоты называют купоросами: FeSO4 • 7Н2O — железный купорос, CuSO4 • 5Н2O — медный купорос, ZnSO4 • 7Н2O — цинковый купорос. Общее название нитратов натрия, калия, аммония, кальция и бария — селитры: NaNO3 — натриевая селитра, NH4NO3 — аммонийная селитра. Кроме того, К2СO3 — поташ, AgNO3 — ляпис, РЬСгO4 — желтый крон, Na2SO4 • 10Н2О — глауберова соль, NaCl — поваренная соль, Na2CO3 • 10Н2O — сода кристаллическая, CaSO4 • 2Н2O — гипс.
Общие химические свойства солей
- Соли взаимодействуют с кислотами при соблюдении некоторых условий.
- Соли взаимодействуют со щелочами при соблюдении некоторых условий.
- Растворы солей взаимодействуют с металлами (вспомните электрохимический ряд напряжений металлов и сформулируйте условия протекания таких реакций).
- Соли взаимодействуют с другими солями в растворах при соблюдении ряда условий.
- Соли подвергаются гидролизу (вспомните случаи гидролиза солей).
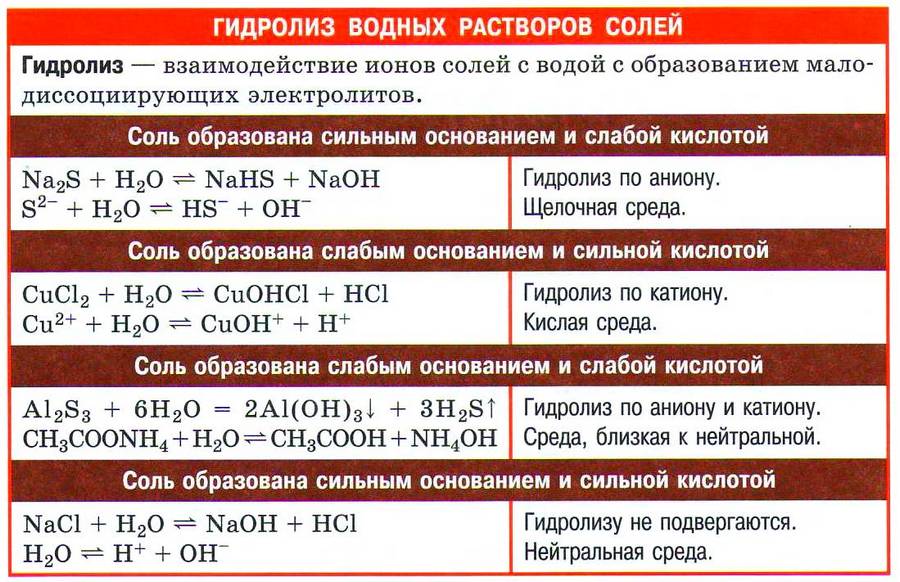
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
















![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)