Оксиды
Оксиды
– бинарные соединения, одним из двух элементов в которых является
кислород
со степенью окисления
-2.
Связь
между оксидом и
гидроксидами
.
Степень
окисле
ния
Оксид
Гидроксиды
Примеры
Основания
Кислоты
+1
Э
2
О
ЭОН
НЭО
КОН
Н
ClO
+2
ЭО
Э(ОН)
2
Н
2
ЭО
2
Ba
(
OH
)
2
?
+3
Э
2
О
3
Э(ОН)
3
НЭО
2
(
мета
-форма)
—(+
H
2
O
)
Н
3
ЭО
3
(
орто
-форма
)
Al(OH)
3
HNO
2
H
3
PO
3
+4
ЭО
2
——
H
2
ЭО
3
H
4
Э
O
4
——
Н
2
СО
3
H
4
SiO
4
+5
Э
2
О
5
——
НЭО
3
Н
3
ЭО
4
——
HNO
3
H
3
PO
4
+6
ЭО
3
——
H
2
Э
O
4
——
H
2
SO
4
+7
Э
2
О
7
——
НЭО
4
—
(+ 2H
2
O)
H
5
ЭО
6
——
HClO
4
H
5
IO
6
КИСЛОТНОСТЬ
основания
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле
:
однокислотные
– содержащие только 1
гидроксогруппу
двухкислотные
– имеющие 2
гидроксогруппу
;
трёхкислотные
– с тремя группами ОН
.
Построение названий
солей
Соль какой кислоты
Кислотный остаток
Название солей
Примеры
Высшие кислоты
Азотная HNO
3
NO
3
—
нитр
ат
ы
Ca(NO
3
)
2
нитрат кальция
Кремниевая H
2
SiO
3
SiO
3
2
—
силик
ат
ы
Na
2
SiO
3
силикат натрия
Угольная H
2
CO
3
CO
3
2
—
карбон
ат
ы
Na
2
CO
3
карбонат натрия
Фосфорная H
3
PO
4
PO
4
3-
фосф
ат
ы
AlPO
4
фосфат алюминия
Серная H
2
SO
4
SO
4
2
—
сульф
ат
ы
PbSO
4
сульфат свинца
Бескислородные кислоты
Бромо
водород
ная
HBr
Br
—
бром
ид
ы
NaBr
бромид натрия
Иодо
водород
ная HI
I
—
иод
ид
ы
KI иодид калия
Серо
водород
ная H
2
S
S
2
—
сульф
ид
ы
FeS
сульфид железа (II)
Соляная HCl
(хлоро
водород
ная)
Cl
—
хлор
ид
ы
NH
4
Cl хлорид аммония
Фторо
водород
ная HF
F
—
фтор
ид
ы
CaF
2
фторид кальция
Более низкая степ.
ок
.
C
ерн
ист
ая
кислота H
2
SO
3
SO
3
2
—
сульф
ит
ы
К
2
SO
3
сульф
ит
калия
Азотистая HNO
2
NO
2
—
нитр
ит
ы
КNO
2
нитрит калия
План
Классификация неорганических веществ.
Металлы и неметаллы.
Оксиды. Их классификация.
Основания и их классификация.
Кислоты и их классификация.
Соли. Классификация солей. Номенклатура солей.
Бытовые названия
некоторых солей.
Классификация
кислот по числу атомов водорода.
Одноосновные
Двухосновные
Трехосновные
HNO
3
азотная
HF фтороводородная
HCl хлороводородная
HBr бромоводородная
HI иодоводородная
H
2
SO
4
серная
H
2
SO
3
сернистая
H
2
S сероводородная
H
2
CO
3
угольная
H
2
SiO
3
кремниевая
H
3
PO
4
фосфорная
Комплексные соли
Комплексные соли
– содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких
лигандов
(отрицательно заряженные ионы или молекулы аммиака или воды).
Пример
:
K
[
Al
(
OH
)
4
] –
тетрагидроксо
алюминат
калия
K
4
[
Fe
(
CN
)
6
] –
гексациано
феррат
калия
[
Cu
(
NH
3
)
4
]
Cl
2
– хлорид
тетрааммин
меди
(
II
)
Амфотерные металлы
По химическим свойствам среди металлов выделяют группу так называемых
амфотерных
металлов.
Это
название отражает
способность этих металлов, их оксидов и
гидроксидов
реагировать как с кислотами, так и со щелочами.
Цинк, алюминий, хром, марганец, железо.
Типы
оснований
Растворимые
(Щелочи)
Нерастворимые
1) гидроксиды металлов первой группы главной подгруппы:
LiOH
,
NaOH
,
KOH
,
RbOH
,
CsOH
2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция:
Ca(OH)
2
,
Sr
(OH)
2
,
Ba
(OH)
2
Все остальные гидроксиды металлов.
Номенклатура
солей
В названиях солей используются латинские названия образующих кислоты неметаллов.
Элемент
Латинское название
Корень
Н
гидрогениум
ГИДР-
С
карбоникум
КАРБ-
N
нитрогениум
НИТР-
S
сульфур
СУЛЬФ-
Смешанные соли
Смешанные соли
– имеют два разных аниона кислотных остатков. В названии их называют через дефис
:
Са
OCl
2
или
CaCl
(
OCl
) — хлорид-гипохлорит кальция (традиционное название хлорная известь).
Классификация
неорганических
веществ
Лекция №9
Подготовка к ЕГЭ
HI
H
2
SO
4
LiOH
Основания
Основания
– сложные вещества, содержащие в своем составе
гидроксид-ионы
ОН
—
и при диссоциации образующие
в качестве анионов только эти ионы.
Классификация кислот по составу
Кислородсодержащие кислоты
Бескислородные кислоты
1) высшие кислоты
H
2
SO
4
серная кислота
HNO
3
азотная кислота
H
3
PO
4
фосфорная кислота
H
2
CO
3
угольная кислота
H
2
SiO
3
кремниевая кислота
2) кислоты с меньшей степенью окисления неметалла
H
2
SO
3
серн
ист
ая кислота
HNO
2
азот
ист
ая кислота
HF фторо
водород
ная кислота
HCl
хлоро
водород
ная
кислота (соляная кислота)
HBr
бромо
водород
ная
кислота
HI
иодо
водород
ная
кислота
H
2
S серо
водород
ная кислота
Построение названий солей
Более низкая степ.
ок
.
C
ерн
ист
ая
кислота H
2
SO
3
SO
3
2
—
сульф
ит
ы
К
2
SO
3
сульф
ит
калия
Азот
ист
ая HNO
2
NO
2
—
нитр
ит
ы
КNO
2
нитрит калия
Соль какой кислоты
Кислотный остаток
Название солей
Примеры
Металлы и неметаллы
Гидроксиды
Гидроксиды – соединения, в состав которых входит группа Э–О-Н.
И
основания, и кислородсодержащие кислоты, и
амфотерные
гидроксиды – относятся
к ГИДРОКСИДАМ!
Классификация солей
СОЛИ
Средние
Кислые
Основ-ные
Двойные
Сме-шанные
Комплексные
Продукт
полного замещения
атомов водорода в кислоте на металл
Продукт
непол-ного
замещения атомов
водоро-да
в кислоте на металл
Продукт
непол-ного
заме-щения
ОН-
групп
на кислотный остаток
Содержат
два разных металла
и один кислотный остаток
Содержат
один металл и два кислотных остатка
Содержат
комплексный катион или анион –
атом металла, связанный с несколькими
лигандами
.
AlCl
3
К
H
SO
4
Fe
OH
Cl
K
Al
(SO
4
)
2
Ca
Cl
Br
K
2
[Zn(OH)
4
]
Хлорид алюминия
Гидро
сульфат калия
Хлорид
гидроксо
железа
(II)
Сульфат
алюминия-
калия
Хлорид-
бромид
кальция
Тетрагидроксоцинкат
калия
Двойные соли
Двойные соли
– имеют два разных катиона металла или аммония.
В
названии их перечисляют через дефис:
(
NH
4
)
Fe
(
SO
4
)
2
– сульфат железа (
III
)-аммония.
Автор:
Калитина Тамара Михайловна
Место работы:
МБОУ СОШ №2 с.Александров-Гай Саратовской области
Должность:
учитель
химии
Дополнительные сведения:
сайт
http://kalitina.okis.ru/
Мини-сайт
http://www.nsportal.ru/kalitina-tamara-mikhailovna
Простые вещества
обычно делят на
металлы и неметаллы
.
Металлы
– простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы
– простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
Пример: Оксид
As
2
O
5
,
степень окисления мышьяка +5.
Составим формулу кислоты:
Н
+
As
+5
O
-2
x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO
3
Это
МЕТА-форма кислоты
—
мета-мышьяковая
кислота.
Но для фосфора и мышьяка существует и более устойчива
ОРТО-форма
. Прибавив к
мета-форме
Н
2
О
, получим
H
3
AsO
4
.
Это
орто
— мышьяковая кислота.
Соли
Соли
– это сложные вещества, состоящие из одного (нескольких)
атомов металла
(или более сложных катионных групп, например, аммонийных групп
NН
4
+
) и одного (или нескольких)
Построение названий солей
Соль какой кислоты
Кислотный остаток
Название солей
Примеры
Бескислородные
кислоты
Бромо
водород
ная
HBr
Br
—
бром
ид
ы
NaBr
бромид натрия
Иодо
водород
ная HI
I
—
иод
ид
ы
KI иодид калия
Серо
водород
ная H
2
S
S
2
—
сульф
ид
ы
FeS
сульфид железа (II)
Соляная HCl
(хлоро
водород
ная)
Cl
—
хлор
ид
ы
NH
4
Cl хлорид аммония
Фторо
водород
ная HF
F
—
фтор
ид
ы
CaF
2
фторид кальция
Источники
http://egeigia.ru/all-ege/materialy-ege/himiya/566-ege-him-2012-5
Каждому солеобразующему оксиду соответствует гидроксид:
Основным
оксидам соответствуют основания;
Амфотерным
оксидам –
амфотерные
гидроксиды,
Кислотным
оксидам – кислородсодержащие кислоты.
Кислоты
Кислоты
– сложные вещества, содержащие в своем составе ионы
оксония
Н
+
или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Основные соли
Основные соли
, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные
соли
образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки
«
гидроксо
«:
Mg
(
OH
)
Cl
—
гидроксо
хлорид
магния (основная соль)
Классификация неорганических веществ
К важнейшим классам неорганических веществ
относят
:
простые вещества
(металлы и неметаллы),
оксиды
(кислотные, основные и
амфотерные
),
гидроксиды
(часть кислот, основания,
амфотерные
гидроксиды),
соли.
Оксиды
Основ
ные
Амфотер
ные
Кислотные
Несолеобразующие
Солеобразные
(
двойные)
Оксиды металлов в степенях окисления
+1, +2, кроме
амфотерных
.
Оксиды
металлов
в степенях окисления
+2: только
Be
,
Zn
,
Sn
,
Pb
;
+3
(все, кроме
La
2
O
3
),
+4
1) Оксиды
неметаллов, кроме несолеобразующих
;
2
) Оксиды металлов в степенях окисления
от +5 и выше.
Оксиды неметаллов, которым не соответствуют кислоты.
NO
,
N
2
O
,
CO, (
SiO
)
Некоторые
оксиды,
в которых элемент имеет 2 степени окисления:
Fe
3
O
4
С о л е о б
р
а
з
у
ю
щ
и е
КАК
СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А.
Если чётная степень окисления элемента в оксиде:
ПРИБАВЛЯЕМ ВОДУ
к оксиду.
Пример:
WO
3
–(+
H
2
O
)
H
2
WO
4
Б.
Если нечетная степень окисления:
Мета-форма кислоты
—
ОДИН
атом водорода:
НЭО
х
Орто-форма
кислоты
– отличается от
МЕТА-формы
на одну молекулу воды.
Н
3
ЭО
х+1
Классификация
по силе и устойчивости
Сильные кислоты
Слабые кислоты
HI
иодоводородная
HBr
бромоводородная
HCl
хлороводородная
H
2
SO
4
серная
HNO
3
азотная
HClO
4
хлорная
HF фтороводородная
H
3
PO
4
фосфорная
HNO
2
азотистая
(
неустойчивая)
H
2
SO
3
сернистая
(неустойчивая)
H
2
CO
3
угольная
(неустойчивая)
H
2
S
↑
сероводородная
H
2
SiO
3
↓
кремниевая
СН
3
СООН уксусная
Построение названий солей
Соль какой кислоты
Кислотный остаток
Название солей
Примеры
Высшие кислоты
Азотная HNO
3
NO
3
—
нитр
ат
ы
Ca
(NO
3
)
2
нитрат кальция
Кремниевая H
2
SiO
3
SiO
3
2
—
силик
ат
ы
Na
2
SiO
3
силикат натрия
Угольная H
2
CO
3
CO
3
2
—
карбон
ат
ы
Na
2
CO
3
карбонат натрия
Фосфорная H
3
PO
4
PO
4
3-
фосф
ат
ы
AlPO
4
фосфат алюминия
Серная H
2
SO
4
SO
4
2
—
сульф
ат
ы
PbSO
4
сульфат свинца
Кислые соли
Кислые соли,
помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку
«
гидро
«:
NaHCO
3
–
гидро
карбонат натрия,
K
2
HPO
4
–
гидро
фосфат
калия,
KH
2
PO
4
–
дигидро
фосфат
калия.
Бытовые
(тривиальные) названия некоторых
солей
Соль
Международное название
Традиционное название
NaHCO
3
Гидрокарбонат натрия
Сода питьевая
Na
2
CO
3
Карбонат натрия
Сода кальцинированная
K
2
CO
3
Карбонат калия
Поташ
Na
2
SO
4
Сульфат натрия
Глауберова соль
KClO
3
Хлорат калия
Бертолетова соль
Ca
3
(PO
4
)
2
Фосфат кальция
Фосфорит
СаСО
3
Карбонат кальция
Известняк
CuSO
4
∙5
H
2
O
Пентагидрат сульфата меди
Медный купорос
Na
2
CO
3
∙10Н
2
О
Декагидрат карбоната натрия
Сода кристаллическая
1.
Лекция №4
Классы
неорганических
веществ
2. План лекции:
Классификация неорганических
веществ.
Способы получения, номенклатура,
физические и химические свойства
основных, кислотных и амфотерных
оксидов; амфотерных гидроксидов,
кислот, оснований.
Генетическая связь между классами
неорганических веществ.
3. Классификация неорганических веществ
Вещества
Простыесостоят из атомов
одного химического
элемента.
Сложныесостоят из атомов
разных элементов
4. Простые вещества
Металлы
Na,
Fe,
Al,
Zn…
Благородные
газы
Неметаллы
O2,
H2,
Cl2,
S,
P,
C…
He,
Ne,
Ar,
Kr,
Xe,
Rn
5. Сложные вещества
Оксиды
Гидроксиды
Кислоты
Соли
Основания
Амфотерные
гидроксиды
6. Свойства оксидов и гидроксидов
• Свойства оксидов и гидроксидов в периоде
изменяются от основных через амфотерные к
кислотным, т.к. увеличивается положительная
степень окисления элементов.
+1
+3
Na2 O, Mg O , Al2 O3
+2
основные
+1
амфотерный
+3
NaOН, Mg+2OН , Al(OН)3
щелочь
Амфотерный
Слабое
основание гидроксид
• В главных подгруппах основные свойства
оксидов и гидроксидов возрастают сверху
вниз.
7. Оксиды
Оксиды – это сложные вещества,
состоящие из двух химических элементов,
один из которых – кислород со степенью
окисления -2
Общая формула:
ЭmOn
m число атомов элемента Э,
n – число атомов кислорода.
Называют так – «оксид элемента» (степень
окисления), если она переменна.
Примеры
CO2 оксид углерода (IV)
FeO оксид железа (II)
8.
Классификация оксидов по
кислотно основным свойствам
Оксиды
1) несолеобразующие
N2O, NO, CO, SiO
2) Солеобразующие
Основные
Оксиды металлов
(с.о. +1,+2)
CaO
соответствуют
Основания
Ca(OH)2
Амфотерные
Оксиды металлов
(с.о. +3, +4),
а также оксиды
ВеО, ZnO, SnO, PbO
ZnO
соответствуют
Кислотные
Оксиды
неметаллов,
оксиды металлов
(с.о.+5,+6,+7)
P2O5
соответствуют
кислоты
H3 PO4
9. Оксиды
Несолеобразующие оксиды — оксиды, не
проявляющие ни кислотных, ни основных, ни
амфотерных свойств и не образующие соли
Солеобразующие оксиды – это оксиды,
которые взаимодействуют с кислотами или со
щелочами с образованием соли и воды. Им
соответствуют гидроксиды, содержащие
элемент в той же степени окисления.
10. Основные оксиды
Общая формула Ме2О, МеО
Физические свойства
• При комнатной температуре основные оксиды твердые,
кристаллические вещества чаще всего нерастворимые в воде;
• Окрашенные в различные цвета, например Cu2O – красного цвета,
СаO – белого.
CaO
CuO
Вa
O
Cu2O
11.
ХИМИЧЕСКИЕ СВОЙСТВА
ОСНОВНЫХ ОКСИДОВ (О.О.)
1) О.О. + кислота =соль + вода (реакция обмена)
CaO + H2 SO4 → CaSO4 + H2O
2) О.О. + кислотный оксид = соль
(реакция соединения)
СaO + SiO2 = CaSiO3
3) О.О.(раств) + вода = основание (щелочь)
(реакция соединения)
Na2О + H2O → 2NaOH
4) О.О. + амфотерный оксид = соль
Na2О + ZnO → Na2 ZnO2
12. Физические свойства кислотных оксидов
Агрегатное состояние различное: Р2О5 – твердый,
SiO2 – твердый, СО2 – газообразный, SO3 – жидкий при
комнатной температуре, затвердевающий уже при 17°С
в твердую кристаллическую массу.
Имеют различный цвет.
Все кислотные оксиды, кроме SiO2, растворимы в
воде.
Р2 О 5
SiO2
13.
Химические свойства кислотных
оксидов (К.О.)
1) К.О. + основание = соль + вода (реакция обмена)
CO2 + Mg(OН)2= MgCO3 + H2O
2) К.О. +О.О. = СОЛЬ (реакция соединения)
SO3 + MgO = MgSO4
3) К.О. + вода = кислота (кроме SiO2 )
(реакция соединения)
Р2O5 + 3H2O = 2H3РO4
14. Амфотерные оксиды
Амфотерными
называются оксиды,
которые в зависимости от условий
проявляют основные или кислотные
свойства.
Примеры: ZnO, Al2O3, Cr2O3, V2O3
Амфотерные оксиды с водой
непосредственно не соединяются.
15. Амфотерные оксиды
Al2O3 (оксид алюминия) очень твердые
прозрачные кристаллы. Температура
плавления – 2053 °C, температура кипения –
3000 °C.
Оксид алюминия как минерал называется корунд.
Крупные прозрачные кристаллы корунда используются как
драгоценные камни. Из-за примесей корунд бывает окрашен в
разные цвета: рубин, сапфир.
Cr2O3 (оксид хрома(III)) –кристаллы зеленого
цвета, нерастворимые в воде.
Используют как пигмент при изготовлении
декоративного зеленого стекла и керамики.
ZnO (оксид цинка) – бесцветный
кристаллический порошок, нерастворимый в
воде. Используется для приготовления белой
масляной краски (цинковые белила)
16. Какие элементы периодической системы образуют амфотерные соединения?
????
????
?????????, исключая
, ??
????
элементы побочных
????
???
подгрупп
????
???
????
?? ?
???
????
???
17.
Амфотерные оксиды
Обозначения:
основные
оксиды
амфотерные
оксиды
кислотные
оксиды
18. Химические свойства амфотерных оксидов
Основные свойства
1. С кислотами: ZnO + 2НСl → ZnСl2 + Н2О
2. С кислотными оксидами: ZnO+ SiO2 = ZnSiO3
силикат цинка
Кислотные свойства
1. С основаниями: ZnO + 2NaОН = Na2ZnO2 +Н2О
цинкат натрия
2. С основными оксидами: ZnO + MgО = MgZnO2
19. Способы получения оксидов
1) Взаимодействие простых веществ с кислородом.
S + O2—› SO2
4Al + 3O2 —› 2Al2O3
2) Взаимодействие простых веществ и солей с
кислотами-окислителями.
C + 4HNO3(р-р) —› СO2 + 4NO2 + H2O
Cu + 4HNO3(конц.) —› Cu(NO3)2 + 2NO2 + +
2H2O
Na2SO3 + 2H2SO4—› 2NaHSO4 + SO2 + H2O
3) Горение
•сложных веществ: СН4 + 2О2 = СО2 + 2Н2О
20. Способы получения оксидов
4) Термическое разложение
1.Нерастворимых оснований
Cu(OН)2=CuО + H2O
CaCO3 = CaO + CO2
Mg(OH)2 = MgO + H2O
2. Некоторых кислот
H2SiO3 = SiO2 + H2O
2H3BO3 = B2O3 + H2O
3. Некоторых солей
СаСО3= СО2 + Н2О
21. Гидроксиды
Гидроксиды – это неорганические
соединения, содержащие в составе
гидроксильную группу (-ОН )
Общая формула:
Э(ОН)n
где Э – элемент (металл или неметалл)
22. Классификация гидроксидов
Гидроксиды
Основания
Ca(ОН)2, Fe(OН)3
Cu(ОН)2
NaОН
Амфотерные
гидроксиды
Кислоты
Fe(OН)3, Al(OН)3
Zn(OН)2, Be(OН)2
Н2SO4, НClO4,
Н2WO4, Н2СО3
23. Основания
Основания – это сложные вещества,
состоящие из ионов металлов и связанных
с ними одного или нескольких гидроксидионов (ОН- )
М(ОН)n
+
NaOH
где М – металл, n – число групп ОН и в
то же время заряд иона металла
+2
Ca(OH)2
+3
Fe(OH)3
Называем: гидроксид металла
24. Классификация оснований
по числу
гидроксильных
групп
ОСНОВАНИЯ
по растворимости
в воде
24
25.
Основания.
Гидроксиды щелочных металлов
• Общая формула – МеОН
• Щелочи.
• Белые кристаллические вещества,
гигроскопичны, хорошо растворимы в
воде (с выделением тепла). Растворы
мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
LiOH — гидроксид лития
Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
26.
Гидроксиды металлов IIА группы
• Общая формула – Ме(ОН)2
• Белые кристаллические вещества, в воде
растворимы хуже, чем гидроксиды щелочных
металлов. Ве(ОН)2 – в воде нерастворим.
• Основные свойства усиливаются в ряду:
Ве(ОН)2→ Mg(ОН)2 → Ca(ОН)2 → Sr(ОН)2 →
Вa(ОН)2
• Ве(ОН)2 – амфотерный гидроксид
• Mg(ОН)2 – слабое основание
• Са(ОН)2, Sr(ОН)2, Ва(ОН)2 – сильные основания –
щелочи.
27. Химические свойства растворимых оснований
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
28.
2. Взаимодействуют со всеми кислотами (реакция
нейтрализации)
NaOH + HCl → NaCl + H2O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействуют с растворами солей, если
образуется газ или осадок
2 NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
29.
5. Взаимодействуют с некоторыми
неметаллами (серой, кремнием,
фосфором)
2 NaOH +Si + H2O → Na2SiO3 + 2H2↑
6. Взаимодействуют с амфотерными
гидроксидами
2 NaOH + Zn(ОН)2 → Na2[Zn(OH)4]
30. Химические свойства нерастворимых оснований
1. Взаимодействуют с кислотами (реакция
нейтрализации)
Fe(OH) 2 + H2SO4 → FeSO4 + 2H2O
2. Разложение при нагревании. Нерастворимые
основания при нагревании разлагаются на основный
оксид и воду: t o
Cu(OH)2↓ → CuO + H2O
31. Способы получения растворимых оснований (щелочей)
1. Взаимодействие щелочных и
щелочно-земельных металлов их
оксидов с водой
2Na + 2H2O = 2NaOH + H2
СаO + H2O = Са(OН)2
32. Способы получения нерастворимых оснований
2. Взаимодействие раствора щелочи с
раствором соли
3NaOH + АlCl3 = Al(OH)3 + 3NaCl
2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
33. Кислоты
Кислоты – это сложные вещества,
молекулы которых состоят из атомов
водорода и кислотных остатков.
При электролитической диссоциации
кислот в водном растворе образуются
катионы водорода и анион кислотного
остатка
НСl
H2SO4
H++ Сl 3H++PO43-
34. Физические свойства кислот
При обычных условиях кислоты
могут быть жидкими и твердыми
(борная, ортофосфорная,
вольфрамовая)
Кислоты –едкие жидкости (кроме
кремневой), с кислым вкусом, без
запаха, разъедают многие вещества,
ткани.
35. Классификация кислот
Признаки
классификации
Группы кислот Примеры
Наличие кислорода
в кислотном остатке
А) кислородные;
Б) бескислородные
А) H3PO4, H2SO4;
Основность
А) одноосновные;
Б) многоосновные
А) HNO3, HCl;
Растворимость в
воде
А) растворимые;
Б) нерастворимые
А) HNO3, HCl;
Летучесть
А) летучие;
Б) нелетучие
А) H2S, HNO3
Степень
диссоциации
А) сильные;
Б) слабые
А) HNO3, HCl;
Стабильность
А) стабильные;
А) H2SO4, HCl
Б) HBr, H2S
,
Б) H2SO4, H3PO4
Б) H2SiO3
Б) H2SO4, H3PO4
Б) H2SO3, H2CO3
36. Названия распространенных кислот
Формула
HCL
H2S
Название
Хлороводородная (соляная)
Сероводородная
HBr
HNO3
Бромоводородная
Азотная
HNO2
Азотистая
H2SO4
Серная
H2SO3
Сернистая
H2CO3
Угольная
H2SiO3
Кремниевая
H3PO4
Фосфорная
37. Типичные реакции кислот
1. Кислота + основание = соль + вода
H2SO4 +2 NaOH = Na2SO4 + 2H2O
2. Кислота + оксид металла = соль + вода
2 HCL+CuO = CuCL2 + H2O
38. Типичные реакции кислот
3. Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
Условия: — в ряду напряжений металл должен стоять
до водорода
— в результате реакции должна получиться
растворимая соль
4. Кислота + соль = новая кислота + новая
соль
Условия: — в результате реакции должны получиться газ,
осадок или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
39. Способы получения кислот
1. Взаимодействие кислотных оксидов с водой
SO3 + H2O = H2SO4;
CO2 + H2O = H2CO3;
2. Вытеснение более летучей кислоты из её соли
менее летучей кислотой
NaCl + H2SO4(конц.) = HCl + Na2SO4
3. Гидролиз галогенидов или солей
PCl5 + 4H2O = 3H3PO4 + 5HCl
4. Из простых веществ (для бескислородных
кислот)
H2 + Cl2 = HCl
H 2 + S = H 2S
40. Амфотерные гидроксиды
Амфотерными называются гидроксиды ,
которые в зависимости от условий могут
быть как донорами катионов водорода и
проявлять кислотные свойства, так и их
акцепторами, проявляя основные свойства.
41. Амфотерные гидроксиды
Гидроксид алюминия можно записать
как основание и как кислоту
Al(OH)3 = AlO3H3 =
Основание
= H3AlO3
Кислота
42.
Некоторые гидроксиды с кислотноосновными свойствами:
элемент
Гидроксидоснование
Гидроксид-кислота
Ве
Ве(ОН)2
Н2ВеО2
Zn
Zn(OH)2
H2ZnO2
Al
Al(OH)2
H3AlO3- алюминивая кислота (ортоформа).
HAlO2 – метаалюминиевая кислота (метаформа)
Cr
Cr(OH)3
H3CrO3-хромовая кислота (ортоформа)
HCrO2- метахромовая кислота (метаформа)
Pb
Pb(OH)4
PbO(OH)2
(PbO nH2O)
H4PbO4 – (ортоформа)
H2PbO3- (метаформа)
43. Химические свойства амфотерных гидроксидов
Основные свойства
С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O
Хлорид алюминия
Кислотные свойства
С основаниями:
H3AlO3 + 3NaOH = Na3AlO3+3H2O
Алюминат натрия
44. Способы получения амфотерных гидроксидов
Осаждение разбавленной щёлочью из
растворов солей соответствующего
амфотерного элемента
AlCl3 + NаOH = Al(OH)3 + 3NаCl
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl.
45. Соли
Соли – это сложные вещества,
состоящие из ионов металлов и
кислотных остатков.
Ba SO4 K 3 N
Na3PO4
HCl
H2S
Соли образуются при замещении атомов
водорода в кислоте на ионы металлов.
Например:
Na Cl
Na2S
HNO3
H2SO4
NaNO3
Na2SO4
46. Номенклатура солей
Название
Соли
Название
кислотного
остатка
Название
металла в
родительном
падеже
47. Названия солей бескислородных кислот
называем неметалл ( латинское название) с
суффиксом – ид (в им. падеже);
Металл (в род. падеже).
NaCl – хлорид натрия
Al2S3 – сульфид алюминия
FeBr2 – бромид железа (II)
FeBr3 – бромид железа (III)
48. Названия солей кислородсодержащих кислот
Называем ион кислотного остатка
(в именительном
падеже);
с суффиксами:
-ат
для высшей степени окисления;
-ит
для низшей степени окисления.;
Называем металл (в родительном падеже).
Na2SO4– сульфат натрия
Na2SO3 — сульфит натрия
Fe (NO2)2 – нитрит железа (II)
Fe (NO3) 3 – нитрат железа (III)
49. Номенклатура солей
F–
Cl –
Br –
I–
S 2SO3 2SO4 2CO3 2SiO3 2NO3 –
NO2 –
PO4 3PO3 –
ClO4 –
Na F
NaCl
NaBr
Na I
Na2S
Na2SO3
Na2SO4
Na2CO3
Na2SiO3
Na NO3
Na NO2
Na3PO4
Na PO3
Фторид натрия
Хлорид натрия
Бромид натрия
Иодид натрия
Сульфид натрия
Сульфит натрия
Сульфат натрия
Карбонат натрия
Силикат натрия
Нитрат натрия
Нитрит натрия
Ортофосфат натрия
Метафосфат натрия
50. Алгоритм составления формулы соли бескислородной кислоты
Первое действие: записываем
степени окисления элементов,
находим наименьшее общее кратное
6
Al3+ S2Второе действие: находим
индекс алюминия
6:3=2
Третье действие: находим
индекс серы
6:2=3
+3
2-
Al2 S3
51. Алгоритм составления формулы соли кислородсодержащей кислоты
Первое действие: находим
наименьшее общее кратное
Второе действие: находим
6
Ca2+ (PO4)3-
индекс кальция
6:2=3
Третье действие: находим
индекс кислотного остатка
6:3=2
(PO4)2
2+
Ca3
3-
52. Физические свойства
Соли – кристаллические вещества, в основном белого цвета.
Соли железа – желто — коричневого цвета. Соли меди –
зеленовато-голубого цвета.
По растворимости в воде соли делят
(смотри таблицу растворимости):
Растворимые
Малорастворимые
CaSO4
Безводный гипс
NaCl
Поваренная соль
Нерастворимые
CaCO3
Мел, мрамор, известняк
53. Типы солей
Нормальные (средние) -это соли, в которых все атомы водорода
соответствующей кислоты замещены на атомы металла.
NaCl, Na2SO4, Na3PO4
Кислые — это соли, в которых атомы водорода замещены только
частично.
NaHSO4, Na2HPO4, NaH2PO4
Основные — это соли, в которых группы ОН соответствующего
основания частично замещены на кислотные остатки.
MgOHCl, Al(OH)2NO3
Двойные (смешанные) — это соли, в которых содержится два
разных катиона и один анион.
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные — это соли, в состав которых входит комплексный
йон.
Na2[Zn(OH)4], K3[Fe(CN)6]
54. Химические свойства
Соли реагируют с металлами( исключения активные металлы: Li,
Na, K, Ca, Ba — которые при обычных условиях реагируют с водой):
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Карбонаты, сульфиты разлагаются при нагревании:
СaCO3 = CaO + CO2
55. Химические свойства
Соли реагируют с некоторыми кислотными оксидами:
CaCO3 + SiO2 = CaSiO3 + CO2
Соли реагируют с другими солями с образованием новых
нерастворимых солей:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Соли реагируют с растворимыми основаниями с образованием
нерастворимого основания:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
56. Получение солей
Взаимодействие металлов и неметаллов:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие кислотных оксидов с основными и амфотерными
оксидами:
CaO + CO2 = CaCO3
ZnO + SiO2 = ZnSiO3
Взаимодействие двух разных солей с образованием новой
нерастворимой соли:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H2O
Взаимодействие более активного металла с солями:
FeCl2 + Zn = ZnCl2 + Fe
Действие кислот на металлы, стоящие в ряду напряжений металлов
до H2 :
Zn + 2HCl = ZnCl2 + H2
57. Генетическая связь
Связь между классами
неорганических соединений,
основанная на получении
веществ одного класса из
веществ другого класса,
называется генетической.
58. Генетическая связь между классами неорганических соединений
МЕТАЛЛ
+
СОЛЬ
КИСЛОТНЫЙ
ОКСИД
+
КИСЛОТА
58
59.
Генетическая связь отражается в генетических
рядах. В состав любого генетического ряда
входят вещества различных классов
неорганических соединений.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль → Основание
→ Новая соль.
Уравнения реакций к генетическому кальция
Ca → CaO → Ca(OH)2 → CaCO3 :
2Ca + O2 = 2 CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + H2CO3 = CaCO3 + 2H2O
60.
Генетический ряд неметалла отражает такие
превращения:
Неметалл→ Кислотный оксид →Кислота → Соль.
Уравнения реакций к генетическому ряду
углерода C → CO2 → H2CO3 → CaCO3:
61. Задание для самостоятельной подготовки
Составить уравнения реакций к
генетическому ряду углерода
C → CO2 → H2CO3 → CaCO3
генетический ряд калия
K → K2O → KOH → KCl.
Назвать все вещества.
62. СПАСИБО ЗА ВНИМАНИЕ!
63.
64. Пример:
Записать уравнения реакций, с помощью
которых можно осуществить
следующие превращения:
Ca → CaO → Ca(OH)2
CaSO3
S → SO2 → H2SO3
65. Генетическая связь между классами неорганических соединений
Решение:
2Ca + O2 → CaO
CaO + H2O → Ca(OH)2
Ca(OH)2 + SO2 → CaSO3 + H2O
Ca(OH)2 + H2SO3 → CaSO3 + 2H2O
S + O2 → SO2
SO2 + H2O → H2SO3
H2SO3 + Ca(OH)2 → CaSO3 + 2H2O
66. Примеры :
Составьте уравнения реакций, схема которой дана
ниже:
CaCO3 → CaO →
Ca(OH)2 → CaCO3 →
Ca(NO3)2
СaCO3 = CaO + CO2
CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + 2H2O
67. Генетический ряд алюминия. Осуществите превращения:
Na3AlO3
Al
Al2O3
Al2(SO4)3
AlCl3
Al(OH)3
68.
Для металлов можно выделить две
разновидности рядов:
1. Генетический ряд , в котором в качестве
основания выступает щёлочь. Этот ряд можно
представить с помощью следуюших
превращений:
металл— основный оксид — щёлочь — соль,
например
генетический ряд калия
K → K2O → KOH → KCl.
69.
2. Генетический ряд, где в качестве основания выступает
нерастворимое основание, тогда ряд можно представить
цепочкой превращений:
металл—основный оксид—соль—нерастворимое
основание—основный оксид—металл.
генетический ряд меди
Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
70.
Среди неметаллов также можно выделить две
разновидности рядов:
1. Генетический ряд неметаллов, где в качестве
звена ряда выступает растворимая кислота.
Цепочку превращений можно представить в
следующем виде:
неметалл—кислотный оксид—растворимая
кислота—соль.
генетический ряд фосфора
P → P2O5 → H3PO4 → Na3PO4.
71.
2.
Генетический ряд неметаллов, где в
качестве звена ряда выступает
нерастворимая кислота :
неметалл—кислотный оксид—соль—кислота-кислотный оксид—неметалл,
генетический ряд кремния
Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Si.
72. Способы получения амфотерных гидроксидов
Осаждение разбавленной щёлочью из растворов
солей соответствующего амфотерного элемента
AlCl3 + NаOH = Al(OH)3 + 3NаCl
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl.
Существует опасность, что щелочь окажется в
избытке:
ZnSO4 + 4NaOH(изб.) = Na2[Zn(OH)4] +
Na2SO4
73. Алгоритм составления формулы соли
При составлении формулы соли необходимо:
расставить
заряды ионов металлов и
заряды ионов кислотных остатков;
по правилу креста расставить
коэффициенты.
Чётные коэффициенты сократить.
74. Химические свойства
Соли реагируют с металлами( исключения активные металлы: Li,
Na, K, Ca, Ba — которые при обычных условиях реагируют с водой):
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Карбонаты, сульфиты разлагаются при нагревании:
СaCO3 = CaO + CO2
Некоторые соли способны реагировать с водой с образованием
кристаллогидратов:
CuSO4 + 5H2O = CuSO4 *5H2O + Q
75.
Солеобразующие оксиды
ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ
• Основными называются оксиды, которые
образуют соли при взаимодействии с
кислотами или кислотными оксидами.
• Кислотными называются оксиды, которые
образуют соли при взаимодействии с
основаниями или основными оксидами.
• Амфотерными оксидами, называют оксиды
которые проявляют свойства как кислот, так и
оснований.
1
Классы неорганических соединений Подготовка к ЕГЭ
2
Оксиды Образованы двумя химическими элементами Один из элементов кислород, имеющий степень окисления -2 Примеры: MgO, H 2 O
3
Оксидами являются оба вещества в паре 1)MgO и H 2 O 2 2)Na 2 O 2 и BaO 3)Mn 2 О 7 и N 2 O 3 4)F 2 О и P 2 O 5
4
Классификация оксидов Несолеобразующие (безразличные) NO CO N 2 O Солеобразующие Основные Кислотные Амфотерные
5
Основные оксиды Оксиды металлов, в которых металл имеет степень окисления +1 или +2 как правило Основным оксидам соответствуют основания (основные гидроксиды): Na 2 O – NaOH MgO – Mg(OH) 2
6
Свойства основных оксидов Реагируют с кислотами: MgO + H 2 SO 4 = MgSO 4 + H 2 O Некоторые реагируют с водой (оксиды щелочных и щелочно-земельных металлов): Na 2 O + H 2 O = 2NaOH Реагируют с кислотными оксидами: CaO + CO 2 = CaCO 3
7
Кислотные оксиды Оксиды неметаллов и металлов, в которых элемент имеет степень окисления +4 и выше как правило Кислотным оксидам соответствуют кислоты (кислотные гидроксиды): CO 2 – H 2 CO 3 Mn 2 O 7 – HMnO 4 SO 3 – H 2 SO 4 CrO 3 – H 2 CrO 4, H 2 Cr 2 O 7
8
Свойства кислотных оксидов Реагируют со щелочами (растворимыми в воде основаниями): CO 2 + 2NaOH = Na 2 CO 3 + H 2 O Большинство реагирует с водой: SO 3 + H 2 O = H 2 SO 4 Реагируют с основными оксидами: P 2 O 5 + 3CaO = Ca 3 (PO 4 ) 2
9
Амфотерные оксиды Оксиды металлов, в которых металл проявляет степень окисления +3 или +4 как правило Амфотерным оксидам соответствуют амфотерные гидроксиды: Al 2 O 3 – Al(OH) 3 ZnO – Zn(OH) 2 Cr 2 O 3 – Cr(OH) 3 BeO – Be(OH) 2 MnO 2 – Mn(OH) 4
10
Свойства амфотерных оксидов Амфотерность – двойственность свойств Реагируют с кислотами, проявляя свойства основных оксидов: Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O Реагируют со щелочами, проявляя свойства кислотных оксидов: Al 2 O 3 + 2NaOH + 3H 2 O= 2Na[Al(OH) 4 ] Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O (при сплавлении)
11
С водой реагируют оксиды: 1)BaO и SiO 2 2)СuO и SO 3 3)BaO и SO 3 4)FeO и СО 2
12
Оксид серы (IV) взаимодействует с каждым из двух веществ: 1)H 2 O и KCl 2)Ba(OH) 2 и CaO 3)CaCO 3 и ZnSO 3 4)Ca(OH) 2 и N 2
13
С соляной кислотой реагируют каждый из двух оксидов 1)K 2 O и SO 3 2)Al 2 O 3 и CaO 3)CO 2 и ZnO 4)CrO 3 и Na 2 O
14
И с раствором гидроксида натрия и с серной кислотой реагирует 1)ВаO 2) Cr 2 O 3 3) SiO 2 4) MgO
15
Гидроксиды Основные – основания (щелочи и нерастворимые в воде) Кислотные – кислоты кислородсодержащие Амфотерные
16
Только кислоты расположены в ряду 1)HNO 3, Ca(NO 3 ) 2, NO 2 2)KHCO 3, Ba(HSO 4 ) 2, Zn(OH)Cl 3)HNO 2, HNO 3, CH 3 COONa 4)H 2 S, Н 2 SO 3, CH 3 COOH
17
Оцените правильность следующих суждений: А) Гидроксиды по свойствам делятся на кислоты, основания и амфотерные гидроксиды. Б) Гидроксиды элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи). 1)верно только А 2)верно только Б 3)верны оба суждения 4)оба суждения неверны
18
Щелочи – растворимые в воде основания Щелочи образуют металлы 1 группы главной подгруппы (щелочные металлы) и щелочноземельные металлы (Ca, Sr, Ba) Примеры: NaOH, Ca(OH) 2
19
Свойства щелочей Реагируют с кислотами: 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O Реагируют с кислотными оксидами: 2NaOH + CO 2 = Na 2 CO 3 + H 2 O Реагируют с растворами солей, если выпадает осадок: 2NaOH+ CuSO 4 = Cu(OH) 2 + Na 2 SO 4 Реагируют с металлами, образующими амфотерные оксиды и гидроксиды: 2NaOH + Zn +2H 2 O = Na 2 [Zn(OH) 4 ] + Н 2
20
Нерастворимые в воде основания Реагируют с кислотами: Mg(OH) 2 + 2HNO 3 = Mg(NO 3 ) 2 +2H 2 O Разлагаются при нагревании: Mg(OH) 2 = MgO +H 2 O
21
Кислотные гидроксиды – кислородсодержащие кислоты Реагируют с основаниями: KOH + HNO 3 = KNO 3 + H 2 O Реагируют с основными оксидами: MgO + H 2 SO 4 = MgSO 4 + H 2 O Реагируют с металлами, стоящими в ряду напряжений до водорода: Mg + H 2 SO 4 = MgSO 4 + H 2 Реагируют с солями: Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
22
Амфотерные гидроксиды Реагируют с кислотами, проявляя свойства оснований: Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O Реагируют со щелочами, проявляя свойства кислот: Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
23
Гидроксид натрия не взаимодействует с 1)CuCl 2 2)SO 2 3)PbS 4)HNO 3
24
Гидроксид натрия реагирует со всеми веществами ряда: 1)Zn, Na 2 CO 3, CuO 2)CO 2, H 3 PO 4 CuO 3)S O 3, H 3 PO 4, AI 2 O 3 4)SO 3, MgO, H 3 PO 4,
25
Гидроксид калия реагирует со всеми веществами группы 1)Zn, SiO 2, H 2 O 2)HNO 3, Na 2 CO 3, Mg 3)CuSO 4, SO 3, H 3 PO 4 4)CuO, Cа(OH) 2, N 2 O 5
26
В ряду превращений: CuOCuCl 2Cu(OH) 2 вещества X и Y соответственно 1)НСl и NaOH 2)HCl и Fe(OH) 3 3)NaCl и Н 2 O 4)Cl 2 и H 2 O
27
В ряду превращений NaOHNa 2 CO 3 CO 2 веществa X и Y соответственно 1)Н 2 CO 3 и NaOH 2)CaCO 3 и NaOH 3)CO 2 и H 2 O 4)CO 2 и H 2 SO 4
28
Каждое из перечисленных веществ: CuCl 2, SO 3, H 3 PO 4, Zn(OH) 2 реагирует с 1)серной кислотой 2)водой 3)гидроксидом натрия 4)оксидом углерода(VI)
29
При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH) 2 3) Na 2 ZnO 2 4)Na 2 [Zn(OH) 4 ]
30
Исходные вещества А) Al + NaOH + H 2 O Б) Al 2 O 3 + NaOH ( плавление) В) Al 2 O 3 + NaOH+ H 2 O Г) Al(OH) 3 + NaOH Продукты реакции 1) Na[Al(OH) 4 ] 2) Al(OH) 3 + Na 2 O 3) Na[Al(OH) 4 ] + H 2 4) NaAlO 2 + H 2 O 5) NaAlO 2 6) NaAlO 2 + H 2
Классификация и свойства веществ
Задание
Сложные вещества
Оксиды
Основания
Амфотерные гидроксиды
Кислоты
Соли
Задание
Оксиды
Солеобразующие
Несолеобразующие
Кислотные
Амфотерные
Основные
Задание
Оксиды
Несолеобразующие
Солеобразующие
Кислотные
Амфотерные
Основные
+ вода
Щелочь
+ кислотный
оксид
Соль
+ кислота
Соль + вода
Задание
Оксиды
Солеобразующие
Несолеобразующие
Кислотные
Амфотерные
Основные
+ кислота
Соль + вода
+ щелочь
Соль + вода
Задание
Оксиды
Несолеобразующие
Солеобразующие
Кислотные
Амфотерные
Основные
+ вода
Кислота (растворимая)
+ основный
оксид
Соль
+ щелочь
Соль + вода
Задание
Основания
Двухкислотные
Однокислотные
Нерастворимые основания
Растворимые (щелочи)
Задание
Основания
Двухкислотные
Однокислотные
Нерастворимые основания
Растворимые (щелочи)
+ кислота
Соль + вода
нагревание
Основный оксид + вода
Задание
Основания
Нерастворимые основания
Растворимые (щелочи)
+ индикатор
Изменение окраски
+ кислотный оксид
Соль + вода
+ амфотерный оксид
Соль + вода
+ амфотерный гидроксид
Соль + вода
+ кислота
Соль + вода
+ растворимая соль
Задание
Амфотерные гидроксиды
+ кислота
Соль + вода
Соль + вода
+ щелочь
Амфотерный оксиды
нагревание
+ вода
Задание
Кислоты
Химические свойства
Кислородсодержащие
по содержанию
кислорода в молекуле
Бескислородные
Одноосновные
по основности
Двухосновные
Трехосновные
Растворимые
по растворимости
в воде
Нерастворимые
Задание
Кислоты
+ индикатор
Изменение окраски
+ металл
Соль + водород
Соль + вода
+ основный оксид
+ амфотерный оксид
Соль + вода
+ основание
Соль + вода
+ амфотерный гидроксид
Соль + вода
Задание
Соли
Растворимые
Нерастворимые
Составить уравнения реакций
характеризующие свойства вещества.
2) N 2 O 5
1) BaO
3) Cr(OH) 3
4) LiOH
5) HClO 4
6) Fe 2 O 3
Составить уравнения реакций.
1) Na X NaCl
2) Mg X Mg(OH) 2
3) CuCl 2 X CuO
4 ) Cu(OH) 2 X CuSO 4
5 ) Na 2 O X NaCl
6) Na X NaCl
Основные классы неорганических соединений.
Преподаватель ГБПОУ ВО ВАТ имени В.П.Чкалова
Кузнецова Е.В.
ЦЕЛИ И ЗАДАЧИ ЗАНЯТИЯ:
Обучающая: Повторить, обобщить и углубить знания и умения студентов о классификации неорганических веществ, о химических свойствах, получении, номенклатуре оксидов, кислот, оснований и солей.
Развивающая:
- развивать умения анализировать и делать выводы;
- способствовать пробуждению интереса к изучаемой дисциплине;
- находить главную мысль в тексте;
- аргументировать свои ответы .
Воспитывающая :
- формирование научно-материалистического мировоззрения;
- воспитание трудолюбия, усидчивости, умения вести диалог.
18.10.16
Кузнецова Екатерина Владимировна
План
- Классификация сложных неорганических веществ.
- Оксиды: состав, названия, классификация, свойства.
- Кислоты: состав, названия, классификация, свойства.
- Основания: состав, названия, классификация, свойства.
- Соли: состав, названия, классификация, свойства.
- Генетическая связь между классами неорганических веществ.
18.10.16
Кузнецова Екатерина Владимировна
Классификация сложных неорганических веществ
Основные
классы
оксиды
кислоты
соли
основания
HCL, HNO 3
СО 2 , Na 2 O
KOH,
Cu(OH) 2
CaSO 4 ,
LiCl
18.10.16
Кузнецова Екатерина Владимировна
Оксиды: состав, названия, классификация, свойства.
- Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
18.10.16
Кузнецова Екатерина Владимировна
Номенклатура
Формула
Название
CO
оксид углерода ( II )
NO
Формула
N 2 O 5
оксид азота ( II )
Fe 2 O 3
Название
оксид железа (III )
оксид азота (V )
CrO 3
оксид хрома (VI )
Mn 2 O 7
оксид марганца (VII )
18.10.16
Кузнецова Екатерина Владимировна
Классификация оксидов
18.10.16
Кузнецова Екатерина Владимировна
Химические свойства оксидов
О сновные — реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все — с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2
Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O
ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3
Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3
18.10.16
Кузнецова Екатерина Владимировна
ПОЛУЧЕНИЕ ОКСИДОВ.
Окисление кислородом
простых веществ
Разложение
2Mg +O 2 =2MgO
сложных веществ
2H 2 S+3O 2 =2H 2 O+2SO 2
нагреванием солей
СaCO 3 =CaO+CO 2
нагреванием оснований
Cu (OH) 2 =CuO+H 2 0
нагреванием кислородсодержащих кислот
нагреванием высших оксидов
Окисление низших оксидов
H 2 SO 3 =H 2 O+SO 2
4CrO 3 =Cr 2 O 3 +3O 2
4FeO+O 2 =2Fe 2 O 3
Вытеснение летучего оксида менее летучим
Na 2 CO 3 +SiO 2 =Na 2 SiO 3 +CO 2
18.10.16
Кузнецова Екатерина Владимировна
Кислоты
- Кислоты — сложные вещества, состоящие из одного или нескольких атомов водорода, способных заместиться на атом металла, и кислотного остатка.
- Число атомов водорода определяет основность кислот.
- Общая формула: Нх(Ас)
18.10.16
Кузнецова Екатерина Владимировна
Классификация по наличию кислорода в кислотном остатке
Бескислородные
Кислородсодержащие
HCl, HBr, HI, H 2 S
анион «-ид» HCl-хлороводородная
(соляная кислота),
Cl — — хлорид H 2 S-сероводородная,
S 2- — сульфид
H 2 SO 4 , HNO 3 , H 2 CO 3 , H 3 PO 4 и другие .
18.10.16
Кузнецова Екатерина Владимировна
КЛАССИФИКАЦИЯ КИСЛОТ ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА В МОЛЕКУЛЕ
КИСЛОТЫ
ОДНООСНОВНЫЕ ТРЕХОСНОВНЫЕ
ДВУХОСНОВНЫЕ H 3 PO 4
HCl, HNO 3
H 2 SO 4 , H 2 CO 3
18.10.16
Кузнецова Екатерина Владимировна
Номенклатура
18.10.16
Кузнецова Екатерина Владимировна
ПОЛУЧЕНИЕ
Кислородсодержащие
1.Кислотный оксид+вода
2.Металл+сильный окислитель
SO 3 +H 2 O=H 2 SO 4 P 2 O 5 +3H 2 O=2H 3 PO 4
3.Cоль+менее летучая кислота
P+5HNO 3 +2H 2 O=3H 3 PO 4 +5NO
Бескислородные
NaNO 3 +H 2 SO 4 =HNO 3 +NaHSO 4
1.Водород+неметалл
2.Cоль+менее летучая кислота
H 2 +Cl 2 =2HCl
NaCl+H 2 SO 4 =2HCl +NaHSO 4
18.10.16
Кузнецова Екатерина Владимировна
Физические свойства кислот
Кислоты
Жидкости H 2 SO 4 HClO 4 и др.
Твердые H 3 PO 4 H 2 SiO 3 и др.
Газообразные HCl H 2 S и др.
18.10.16
Кузнецова Екатерина Владимировна
Химические свойства
1.Изменяют окраску индикаторов
2.Взаимодействие с металлами, стоящими до водорода
H 2 SO 4 +Ca=CaSO 4 +H 2
2HCl+Ca=CaCl 2 +H 2
3.Взаимодействие с основными оксидами
H 2 SO 4 +CaO=CaSO 4 +H 2 O
2HCl+CaO=CaCl 2 +H 2 O
4.Взаимодействие с основаниями
H 2 SO 4 +Ca(OH) 2 =CaSO 4 +2H 2 O
2HCl+Ca(OH) 2 =CaCl 2 +2H 2 O
Кузнецова Екатерина Владимировна
18.10.16
Химические свойства
5.Взаимодействие с амфотерными оксидами
H 2 SO 4 +ZnO=ZnSO 4 +H 2 O
2HCl+ZnO=ZnCl 2 +H 2 O
6.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество
H 2 SO 4 +BaCl 2 =BaSO 4 +2HCl
2HCl+Na 2 CO 3 =2NaCl+H 2 O+CO 2
7.При нагревании
Слабые кислоты легко разлагаются H 2 SiO 3 =H 2 O+SiO 2
H 2 S=H 2 +S
18.10.16
Кузнецова Екатерина Владимировна
Основания
- Основания — сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами — ОН.
- Общая формула: Ме(ОН) х
18.10.16
Кузнецова Екатерина Владимировна
Физические свойства
- Физические свойства: твердые кристаллические вещества.
- В воде растворимые называются — щелочи: LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH) 2 , Sr(OH) 2 ,Ba(OH) 2 ,
- Другие — малорастворимы.
18.10.16
Кузнецова Екатерина владимировна
ПОЛУЧЕНИЕ
Щелочи
1.Металл+вода
2.Оксид+вода
2Na+H 2 O=2NaOH+H 2 Ba+2H 2 O=Ba(OH) 2 +H 2
3.Электролиз растворов
солей щелочных металлов
Li 2 O+H 2 O=2LiOH CaO+H 2 O=Ca(OH) 2
Нерастворимые основания
2NaCl+2H 2 O=2NaOH+Cl 2 +H 2
Соль+щелочь
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
18.10.16
Кузнецова Екатерина владимировна
Действие индикаторов
18.10.16
Кузнецова Екатерина Владимировна
Химические свойства
1.Взаимодействие с кислотами
KOH+HCl=KCl+H 2 O
Cu(OH) 2 +2HCl=CuCl 2 +2H 2 O
2.Взаимодействие с кислотными оксидами
2KOH+CO 2 =K 2 CO 3 +H 2 O
не характерны
3.Взаимодействие с амфотерными оксидами
2KOH+ZnO=K 2 ZnO 2 +H 2 O
не реагируют
4.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание
18.10.16
Кузнецова Екатерина владимировна
Соли
- Соли — сложные вещества, состоящие из атома металла и кислотного остатка (иногда содержат водород).
- Общяя формула : МехАсу
18.10.16
Кузнецова Екатерина владимировна
Классификация солей
18.10.16
Кузнецова Екатерина владимировна
Номенклатура солей
Кислотный остаток (анион)
Cl —
Название соли
F —
хлорид
фторид
NO 3 —
нитрат
NO 2 —
S 2-
нитрит
сульфид
SO 3 2-
сульфит
SO 4 2-
сульфат
CO 3 2-
SiO 3 2-
карбонат
PO 4 3-
силикат
CN —
фосфат
цианид
NCS —
тиоционат
ClO —
ClO 3 —
гипохлорит
хлорат
ClO 4 —
перхлорат
18.10.16
Кузнецова Екатерина владимировна
ПОЛУЧЕНИЕ
1.С использованием металлов
металл+неметалл
2Mg+Cl 2 =MgCl 2
металл+кислота
Zn+2HCl=ZnCI 2 +H 2
металл+соль
2.С использованием оксидов
основной оксид+кислота
Fe+CuSO 4 =FeSO 4 +Cu
кислотный оксид+основание
CaO+2HCl=CaCl 2 +H 2 O
кислотный+основной оксиды
CO 2 +Ca(OH) 2 =CaCO 3 +H2O
CaO+CO 2 =CaCO 3
основной+амфотерный оксиды
Al 2 O 3 +CaO=Ca(AlO 2 ) 2
18.10.16
Кузнецова Екатерина владимировна
ПОЛУЧЕНИЕ
3.Реакция нейтрализации
кислота+основание
4.Из солей
H 2 SO 4 +2NaOH=Na 2 SO 4 +2H 2 O
соль+соль
соль+щелочь
AgNO 3 +NaCl=AgCl +NaNO 3
Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты)
соль+кислота
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
NaOH+H 2 SO 4 =NaHSO 4 +H 2 O
Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2
Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи)
ZnCl 2 +NaOH=ZnOHCl +NaCl
18.10.16
Кузнецова Екатерина владимировна
ФИЗИЧЕСКИЕ СВОЙСТВА
- Соли — твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые.
18.10.16
Кузнецова Екатерина владимировна
ХИМИЧЕСКИЕ СВОЙСТВА
Разложение при прокаливании
CaCO 3 =CaO+CO 2
Cоль+металл
Fe+CuSO 4 =FeSO 4 +Cu
Соль+соль
AgNO 3 +NaCl=AgCl +NaNO 3
Соль+щелочь
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
Соль+кислота
Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2
18.10.16
Кузнецова Екатерина владимировна
Генетическая связь между классами неорганических веществ
Между оксидами, кислотами, основаниями и солями имеется глубокая связь. Зная свойства веществ, можно легко перейти от одного класса соединений к другому.
- Генетическим называется ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
- Например :
- Ca → CaO → Ca(OH) 2 → CaSO 4 .
18.10.16
Кузнецова Екатерина владимировна
Обобщение и систематизация знаний
Выберите из указанных формул соединений:
Ba (OH) 2 ; H 2 S; Fe (NO 3 ) 3 ; H 2 O; S; H 2 SiO 3 ; H 3 PO 4 ; Na 2 SO 4 ; AI(OH) 3 ; Cl 2 ; CuCl 2 ; AgNO 3 ; SO 3 ; KOH; P 2 O 5 ; HCl; CO 2 ; K 2 S; Fe (OH) 3 , NaOH, HNO 3 .
Назовите вещества.
1 вариант
формулы оснований
2 вариант
3 вариант
формулы солей
формулы кислот
18.10.16
Кузнецова Екатерина владимировна
Обобщение и систематизация знаний
1 вариант
2 вариант
формулы оснований
3 вариант
формулы солей
Ba (OH) 2 – гидроксид бария , AI(OH) 3 – гидроксид алюминия ,
KOH – гидроксид калия ;
Fe (OH) 3 – гидроксид железа (III), NaOH – гидроксид натрия
Fe (NO 3 ) 3 – нитрат железа (III);
Na 2 SO 4 – сульфат натрия;
CuCl 2 – хлорид меди (II);
AgNO 3 – нитрат серебра ;
K 2 S – сульфид калия
формулы кислот
H 2 S – сероводородная кислота;
H 2 SiO 3 – кремниевая кислота;
H 3 PO 4 – ортофосфорная кислота;
HCl – соляная кислота; HNO 3 – азотная кислота.
18.10.16
Кузнецова Екатерина владимировна
Обобщение и систематизация знаний
- Напишите уравнения реакций нейтрализации, в результате которых образуются соли:
- а) AlCl 3 ;
- б) BaSO 4 .
- Al(OH )3 + 3HCl = AlCl 3 +3H 2 O
Ba(OH) 2 + H 2 SO 4 = BaSO 4 +2H 2 O
18.10.16
Кузнецова Екатерина владимировна
Обобщение и систематизация знаний
Допишите уравнения тех реакций, которые идут до конца:
- а ) NaOH + HCl→
- б ) CuCl 2 + 2KOH→
- в) NaOH + CaO→
- г) Сu + HCl →
NaCl + H 2 O
Cu(OH) 2 + 2KCl
18.10.16
Кузнецова Екатерина владимировна
Домашнее задание
Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений. – П. 12, В. 1-4,9-12,14, У. 3,6-8,13
18.10.16
Кузнецова Екатерина владимировна
Источники.
- http://selfhacker.net/wp-content/uploads/2015/01/khimiya.jpg
- http://vneshkoly.com.ua/images/download/Shpargalki-zno/Khimiya/consp-8-2.PNG
- http://mplast.by/wp-content/uploads/2015/06/klassifikatsiya-oksidov.png
- http://www.mitht.rssi.ru/2008/equipment/mediana_ch_2/images/2-31.jpg
- http://www.xn--80ajjl0ack.xn--j1amh/sites/default/files/images/product/_1%20%281%29_6.jpg?1423144253
- http://weirdasia.ru/wpcontent/uploads/2015/12/%
- http://www.ybereg.com/images/RUSSIA/kamchatka/mutnovsky.jpg
- http://gost.jofo.ru/data/userfiles/4988/images/511293-9226691e7f69f97ba64fecbbe1420c60.jpg
- http://img.opt-union.ru/alias/images/photocat/446x/1000873055.jpg
- http://uslide.ru/images/3/9885/389/img3.jpg
- http://bonanzleimages.s3.amazonaws.com/afu/images/2827/1467/il_fullxfull.464403258_p4uj_thumb155_crop.jpg
- http://gallery.magic-chat.ru/m-gallery/minerals/unsort/c096c1e2-d8e7-43e6-9e5a-b3dbc148fdb0.jpeghttp://cs629108.vk.me/v629108754/9b20/sDtFfu_SjN4.jpg
18.10.16
Кузнецова Екатерина Владимировна
Презентация на тему «Классификация неорганических веществ»
-
Скачать презентацию (0.17 Мб)
-
211 загрузок -
3.4 оценка
Ваша оценка презентации
Оцените презентацию по шкале от 1 до 5 баллов
- 1
- 2
- 3
- 4
- 5
Комментарии
Добавить свой комментарий
Аннотация к презентации
Презентация на тему «Классификация неорганических веществ» по химии поможет учителю в проведении урока. Особое внимание уделяется классификации неорганических веществ. Демонстрация слайдов содержит формулы и схемы о структуре и особенностях неорганических веществ.
Краткое содержание
- Общая классификация веществ по составу
- Основания
- Амфотерные гидроксиды
- Кислоты
- Классификация неорганических веществ
-
Формат
pptx (powerpoint)
-
Количество слайдов
15
-
Автор
Приходько А.А.
-
Аудитория
-
Слова
-
Конспект
Отсутствует
-
Предназначение
-
Для проведения урока учителем
-
Содержание
-
Слайд 1
Классификация неорганических соединений
11 классы
МОУ «Дубровская СОШ»
Учитель химии и биологии Приходько Альбина Анатольевна
-
Слайд 2
Общая классификация веществ по составу
- Неорганические вещества
- Простые вещества
- Сложные вещества
-
Слайд 3
- Простые вещества состоят из атомов одного химического элемента
- Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом
-
Слайд 4
-
Слайд 5
-
Слайд 6
- Оксиды- это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2.
- Общая формула:
- Примеры:
- Оксиды
- Несолеобразующие
- Солеобразующие
- Основные
- Амфотерные
- Кислотные
-
Слайд 7
По какому признаку солеобразующие оксиды делят на три вида?
- Основной оксид— основание— соль
- Амфотерный оксид—амфотерный гидроксид— соль
- Кислотный оксид— кислота— соль
-
Слайд 8
- Основания –это сложные вещества, состоящие из катионов металла и одного или нескольких гидроксид-ионов.
- Общая формула:
- Пример:
- Основания
- Щёлочи
- Нерастворимые
- основания
-
Слайд 9
Получи нерастворимые основания
1.Налей в 3 пробирки 2-3 мл раствора сульфата железа(2), хлорида магния, сульфата меди(2).
2. Добавь к растворам немного раствора гидроксида натрия.
3.Что наблюдаете?
4.Чем полученные основания отличаются друг от друга?
5.Запишите формулы нерастворимых оснований.
-
Слайд 10
Амфотерные гидроксиды
- Амфотерные гидроксиды- это сложные вещества, которые имеют и свойства оснований и свойства кислот.
- Пример:
-
Слайд 11
- Кислоты -это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
- Общая формула:
- Примеры:
- Кислоты
- Бескислородные
- Кислород-
- содержащие
-
Слайд 12
-
Слайд 13
- Средние соли- это сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
- Кислые соли- это сложные вещества, состоящие из катионов металла и водорода и анионов кислотного остатка.
- Основные соли- это сложные вещества, состоящие из катионов металла и анионов кислотного остатка и гидроксильной группы
-
Слайд 14
Классификация неорганических веществ
- Вещества
- Сложные
- Простые
- Благородные
- газы
- металлы
- неметаллы
- Амфотерные
- гидроксиды
- соли
- основания
- оксиды
- кислоты
- нерастворимые
- бескислородные
- Растворимые(щелочи)
- средние
- основные
- кислые
- кислородсодержащие
- амфотерные
- солеобразующие
- несолеобразующие
- основные
- кислотные
- комплексные
-
Слайд 15
Проверь себя
1.а)- несолеобразующий оксид
б) амфотерный гидроксид
в) кислота
г) основание
Посмотреть все слайды
Сообщить об ошибке
Похожие презентации












Спасибо, что оценили презентацию.
Мы будем благодарны если вы поможете сделать сайт лучше и оставите отзыв или предложение по улучшению.
Добавить отзыв о сайте
Слайды и текст этой презентации
Слайд 1
Слайд 2
Описание слайда:
План лекции:
Классификация неорганических веществ.
Способы получения, номенклатура, физические и химические свойства основных, кислотных и амфотерных оксидов; амфотерных гидроксидов, кислот, оснований.
Генетическая связь между классами неорганических веществ.
Слайд 3
Описание слайда:
Классификация неорганических веществ
Простые-
состоят из атомов одного химического элемента.
Слайд 4
Описание слайда:
Простые вещества
Металлы
Na,
Fe,
Al,
Zn…
Слайд 5
Описание слайда:
Сложные вещества
Оксиды
Слайд 6
Описание слайда:
Свойства оксидов и гидроксидов
Слайд 7
Описание слайда:
Оксиды
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2
Слайд 8
Слайд 9
Слайд 10
Описание слайда:
Основные оксиды
Слайд 11
Слайд 12
Описание слайда:
Физические свойства кислотных оксидов
Слайд 13
Слайд 14
Описание слайда:
Амфотерные оксиды
Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства.
Примеры: ZnO, Al2O3, Cr2O3, V2O3
Амфотерные оксиды с водой непосредственно не соединяются.
Слайд 15
Описание слайда:
Амфотерные оксиды
Слайд 16
Описание слайда:
Какие элементы периодической системы образуют амфотерные соединения?
Слайд 17
Слайд 18
Описание слайда:
Химические свойства амфотерных оксидов
Слайд 19
Описание слайда:
Способы получения оксидов
Слайд 20
Описание слайда:
Способы получения оксидов
Слайд 21
Описание слайда:
Гидроксиды
Гидроксиды – это неорганические соединения, содержащие в составе гидроксильную группу (-ОН )
Слайд 22
Описание слайда:
Классификация гидроксидов
Слайд 23
Описание слайда:
Основания
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов (ОН )
Слайд 24
Описание слайда:
Классификация оснований
Слайд 25
Слайд 26
Слайд 27
Описание слайда:
Химические свойства растворимых оснований
Слайд 28
Слайд 29
Слайд 30
Описание слайда:
Химические свойства нерастворимых оснований
Слайд 31
Описание слайда:
Способы получения растворимых оснований (щелочей)
1. Взаимодействие щелочных и щелочно-земельных металлов их оксидов с водой
2Na + 2H2O = 2NaOH + H2
СаO + H2O = Са(OН)2
Слайд 32
Описание слайда:
Способы получения нерастворимых оснований
2. Взаимодействие раствора щелочи с раствором соли
Слайд 33
Описание слайда:
Кислоты
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
При электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
НСl H++ Сl —
H2SO4 3H++PO43-
Слайд 34
Описание слайда:
Физические свойства кислот
При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая)
Кислоты –едкие жидкости (кроме кремневой), с кислым вкусом, без запаха, разъедают многие вещества, ткани.
Слайд 35
Описание слайда:
Классификация кислот
Слайд 36
Описание слайда:
Названия распространенных кислот
Слайд 37
Описание слайда:
Типичные реакции кислот
1. Кислота + основание = соль + вода
H2SO4 +2 NaOH = Na2SO4 + 2H2O
2. Кислота + оксид металла = соль + вода
2 HCL+CuO = CuCL2 + H2O
Слайд 38
Описание слайда:
Типичные реакции кислот
3. Кислота + металл = водород + соль
2HCL +Zn = ZnCL2 + H2
Условия: — в ряду напряжений металл должен стоять до водорода
в результате реакции должна получиться растворимая соль
4. Кислота + соль = новая кислота + новая соль
Условия: — в результате реакции должны получиться газ, осадок или вода.
BaCL2 + H2SO4 = BaSO4 + 2HCL
Слайд 39
Описание слайда:
Способы получения кислот
1. Взаимодействие кислотных оксидов с водой
SO3 + H2O = H2SO4;
CO2 + H2O = H2CO3;
2. Вытеснение более летучей кислоты из её соли менее летучей кислотой
NaCl + H2SO4(конц.) = HCl + Na2SO4
3. Гидролиз галогенидов или солей
PCl5 + 4H2O = 3H3PO4 + 5HCl
4. Из простых веществ (для бескислородных кислот)
H2 + Cl2 = HCl
H2 + S = H2S
Слайд 40
Описание слайда:
Амфотерные гидроксиды
Слайд 41
Описание слайда:
Амфотерные гидроксиды
Слайд 42
Слайд 43
Описание слайда:
Химические свойства амфотерных гидроксидов
Слайд 44
Описание слайда:
Способы получения амфотерных гидроксидов
Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента
AlCl3 + NаOH = Al(OH)3 + 3NаCl
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl.
Слайд 45
Описание слайда:
Соли
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков.
Ba SO4 K 3 N Na3PO4
Слайд 46
Описание слайда:
Номенклатура солей
Слайд 47
Описание слайда:
Названия солей
бескислородных кислот
называем неметалл ( латинское название) с суффиксом – ид (в им. падеже);
Металл (в род. падеже).
NaCl – хлорид натрия
Al2S3 – сульфид алюминия
FeBr2 – бромид железа (II)
FeBr3 – бромид железа (III)
Слайд 48
Описание слайда:
Названия солей кислородсодержащих кислот
Называем ион кислотного остатка (в именительном падеже);
с суффиксами:
-ат для высшей степени окисления;
-ит для низшей степени окисления.;
Называем металл (в родительном падеже).
Na2SO4– сульфат натрия
Na2SO3 — сульфит натрия
Fe (NO2)2 – нитрит железа (II)
Fe (NO3) 3 – нитрат железа (III)
Слайд 49
Описание слайда:
Номенклатура солей
F –
Cl –
Br –
I –
S 2-
SO3 2-
SO4 2-
CO3 2-
SiO3 2-
NO3 –
NO2 –
PO4 3-
PO3 –
ClO4 –
Слайд 50
Описание слайда:
Алгоритм составления формулы соли
бескислородной кислоты
Первое действие: записываем
степени окисления элементов,
находим наименьшее общее кратное
Al3+ S2-
Второе действие: находим
индекс алюминия
6 : 3 = 2
Третье действие: находим
индекс серы +3 2 —
6 : 2 = 3 Al2 S3
Слайд 51
Описание слайда:
Алгоритм составления формулы соли
кислородсодержащей кислоты
Первое действие: находим
наименьшее общее кратное
Второе действие: находим Ca2+ (PO4)3-
индекс кальция
6 : 2 = 3
Третье действие: находим
индекс кислотного остатка 2 + 3 —
6 : 3 = 2 Ca3 (PO4)2
Слайд 52
Описание слайда:
Физические свойства
Слайд 53
Описание слайда:
Типы солей
Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла.
NaCl, Na2SO4, Na3PO4
Кислые — это соли, в которых атомы водорода замещены только частично.
NaHSO4, Na2HPO4, NaH2PO4
Основные — это соли, в которых группы ОН соответствующего основания частично замещены на кислотные остатки.
MgOHCl, Al(OH)2NO3
Двойные (смешанные) — это соли, в которых содержится два разных катиона и один анион.
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные — это соли, в состав которых входит комплексный йон.
Na2[Zn(OH)4], K3[Fe(CN)6]
Слайд 54
Описание слайда:
Химические свойства
Слайд 55
Описание слайда:
Химические свойства
Слайд 56
Описание слайда:
Получение солей
Слайд 57
Описание слайда:
Генетическая связь
Слайд 58
Описание слайда:
Генетическая связь между классами
неорганических соединений
Слайд 59
Описание слайда:
Генетическая связь отражается в генетических рядах. В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Генетическая связь отражается в генетических рядах. В состав любого генетического ряда входят вещества различных классов неорганических соединений.
Генетический ряд металла показывает:
Металл → Основной оксид → Соль → Основание → Новая соль.
Уравнения реакций к генетическому кальция Ca → CaO → Ca(OH)2 → CaCO3 :
2Ca + O2 = 2 CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + H2CO3 = CaCO3 + 2H2O
Слайд 60
Описание слайда:
Генетический ряд неметалла отражает такие превращения:
Неметалл→ Кислотный оксид →Кислота → Соль.
Уравнения реакций к генетическому ряду углерода C → CO2 → H2CO3 → CaCO3:
Слайд 61
Описание слайда:
Задание для самостоятельной подготовки
Составить уравнения реакций к генетическому ряду углерода
C → CO2 → H2CO3 → CaCO3
Назвать все вещества.
Слайд 62
Описание слайда:
СПАСИБО ЗА ВНИМАНИЕ!
Слайд 63
Слайд 64
Описание слайда:
Пример:
Записать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Ca → CaO → Ca(OH)2
CaSO3
S → SO2 → H2SO3
Слайд 65
Описание слайда:
Генетическая связь между классами
неорганических соединений
Решение:
2Ca + O2 → CaO
CaO + H2O → Ca(OH)2
Ca(OH)2 + SO2 → CaSO3 + H2O
Ca(OH)2 + H2SO3 → CaSO3 + 2H2O
S + O2 → SO2
SO2 + H2O → H2SO3
H2SO3 + Ca(OH)2 → CaSO3 + 2H2O
Слайд 66
Описание слайда:
Примеры :
Слайд 67
Описание слайда:
Генетический ряд алюминия.
Осуществите превращения:
Na3AlO3
Al Al2O3 AlCl3 Al(OH)3
Al2(SO4)3
Слайд 68
Слайд 69
Слайд 70
Слайд 71
Слайд 72
Описание слайда:
Способы получения амфотерных гидроксидов
Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента
AlCl3 + NаOH = Al(OH)3 + 3NаCl
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl.
Существует опасность, что щелочь окажется в избытке:
ZnSO4 + 4NaOH(изб.) = Na2[Zn(OH)4] + Na2SO4
Слайд 73
Описание слайда:
Алгоритм составления формулы соли
При составлении формулы соли необходимо:
расставить заряды ионов металлов и заряды ионов кислотных остатков;
по правилу креста расставить коэффициенты.
Чётные коэффициенты сократить.
Слайд 74
Описание слайда:
Химические свойства
Слайд 75

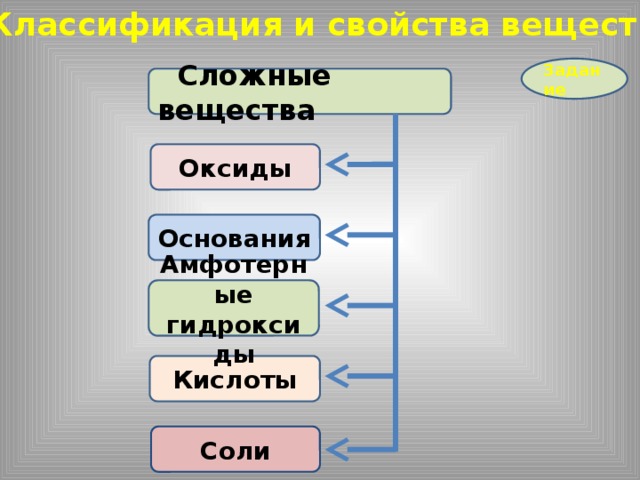
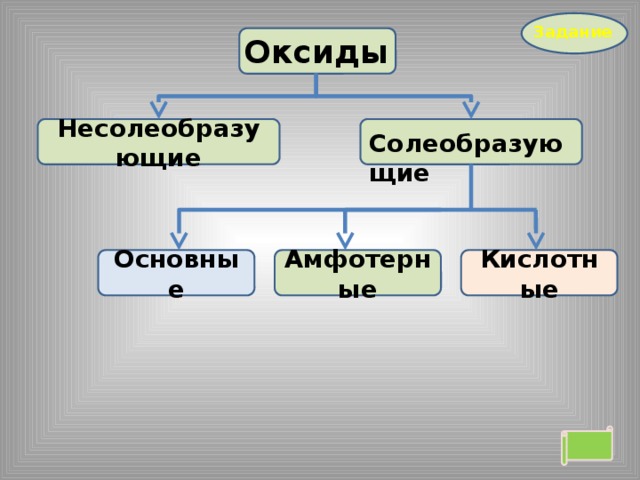
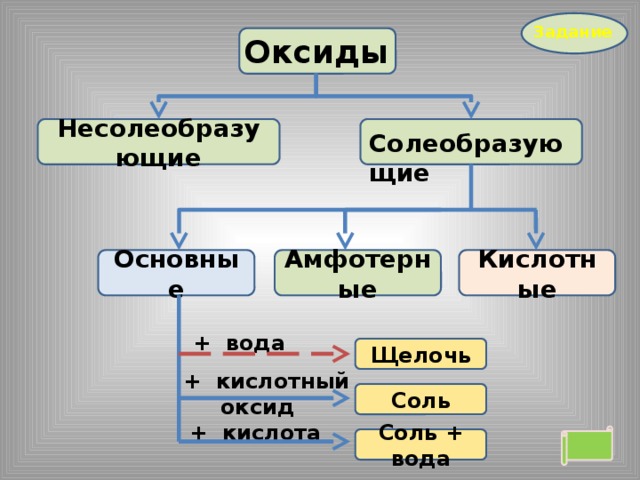
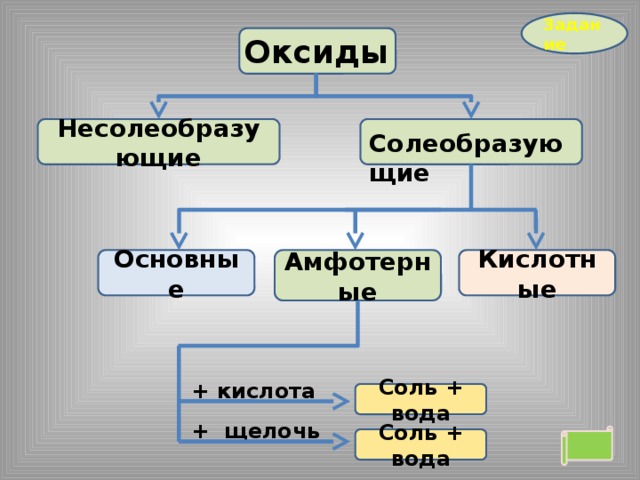
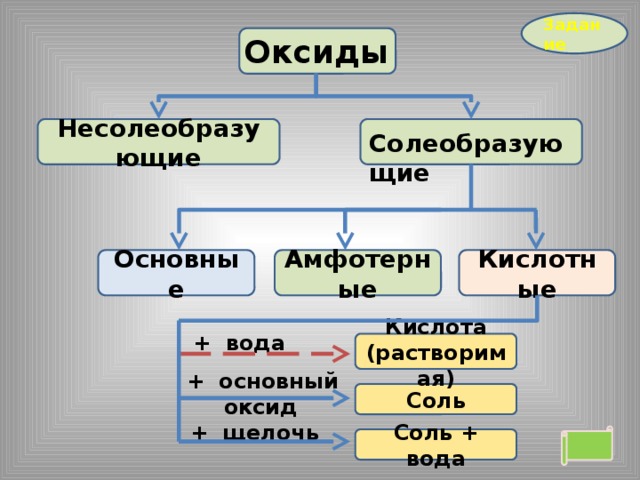

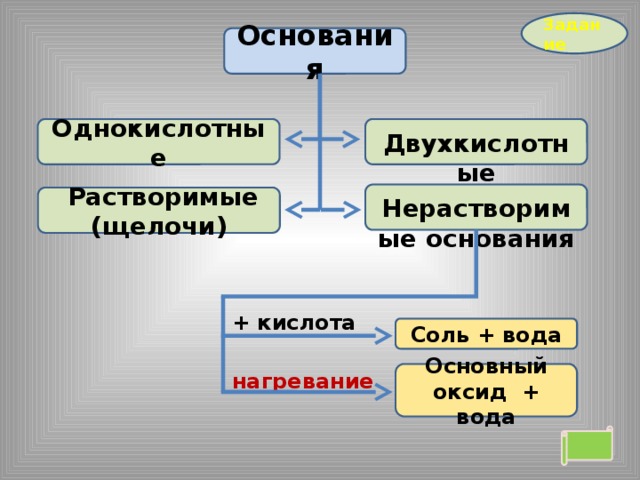
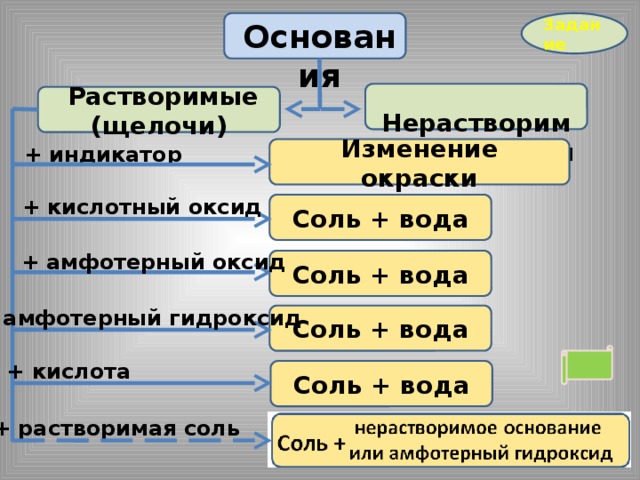
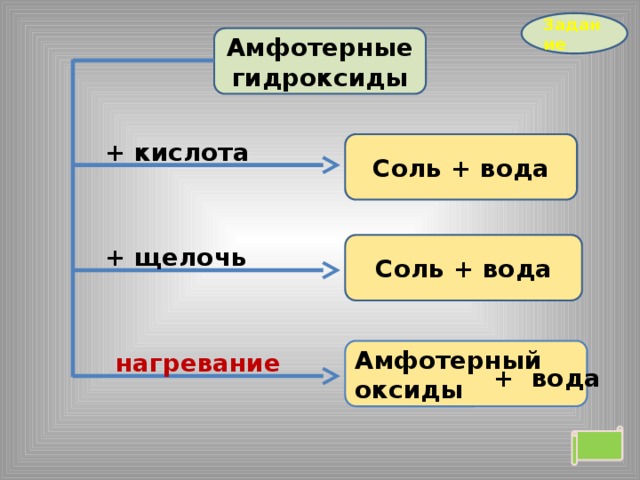
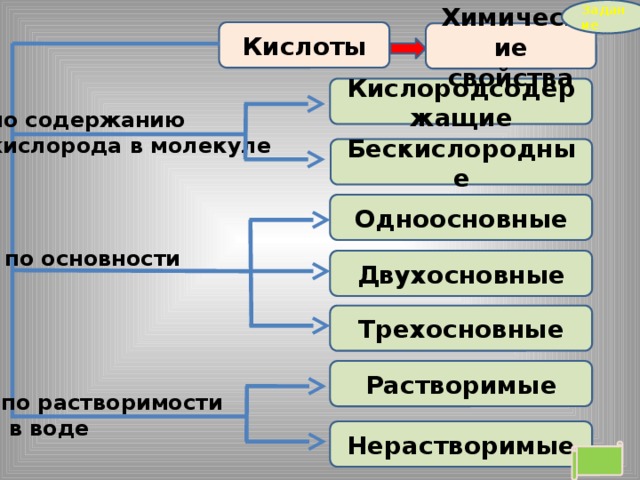
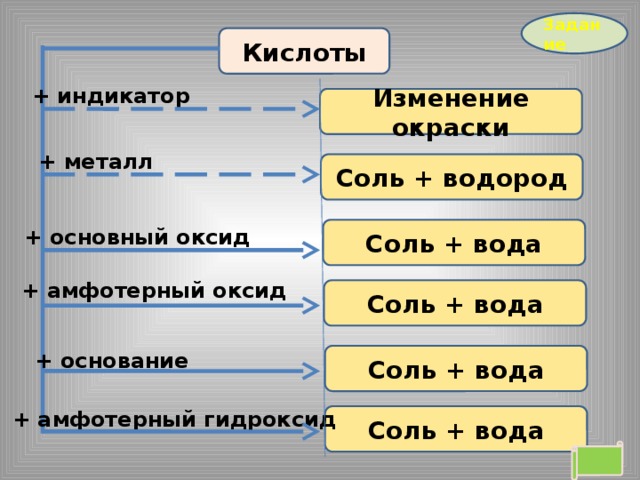
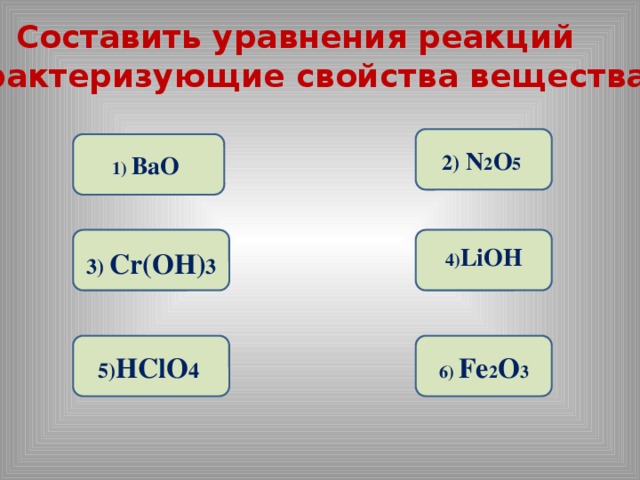




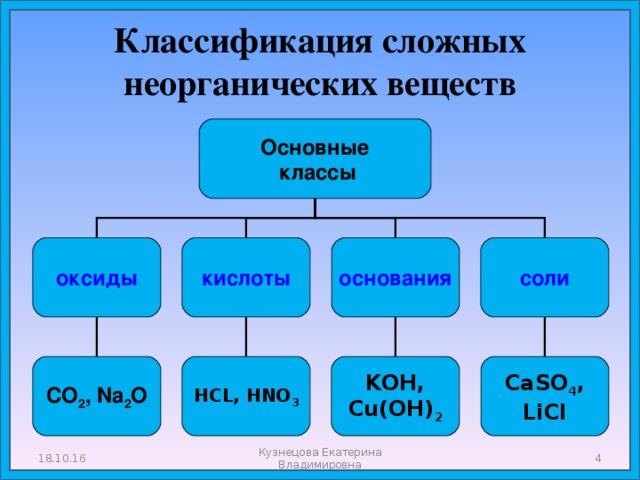


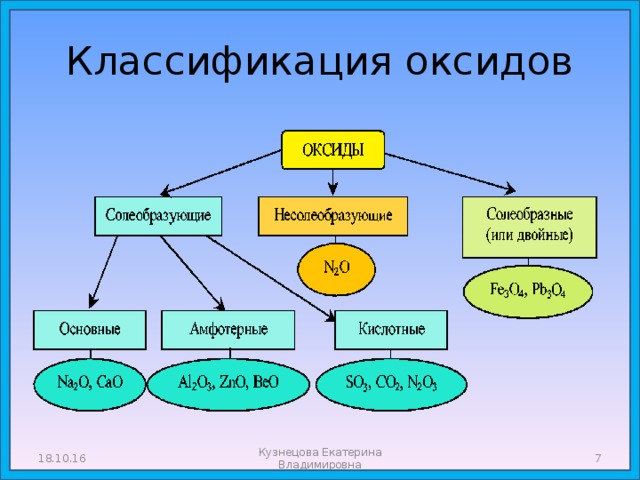
![Химические свойства оксидов О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2 Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3 Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3 18.10.16 Кузнецова Екатерина Владимировна](https://fhd.multiurok.ru/4/e/3/4e3a64e84a66e14dfba0eec46a127212d3880e30/img7.jpg)















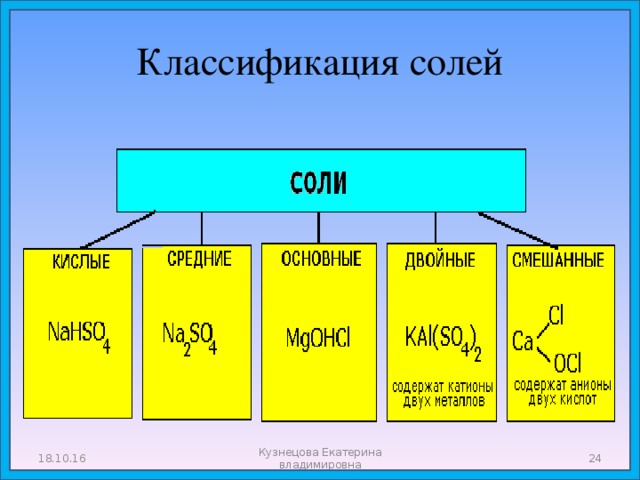
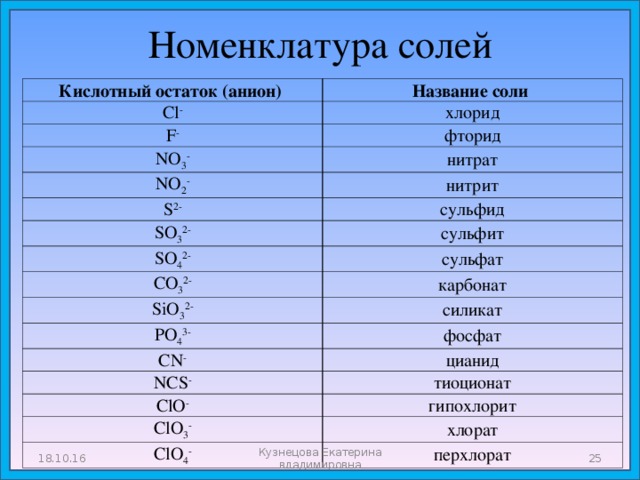




























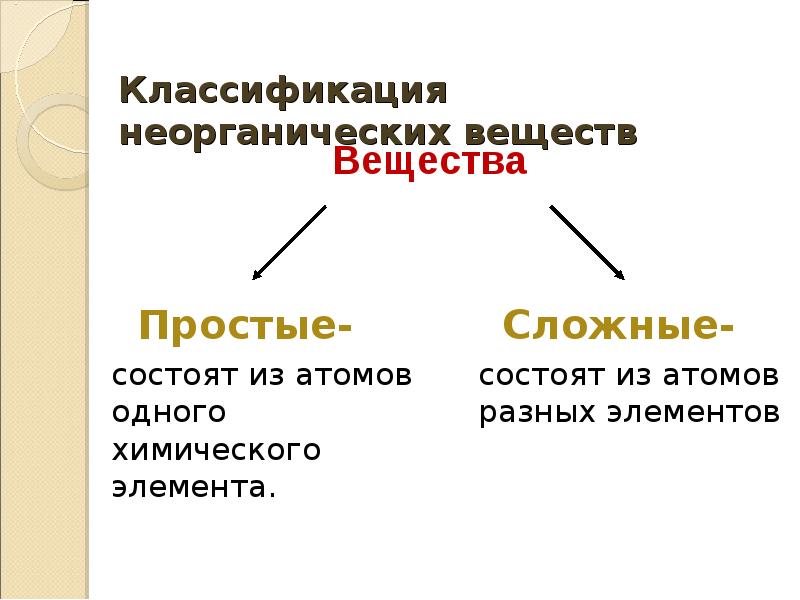
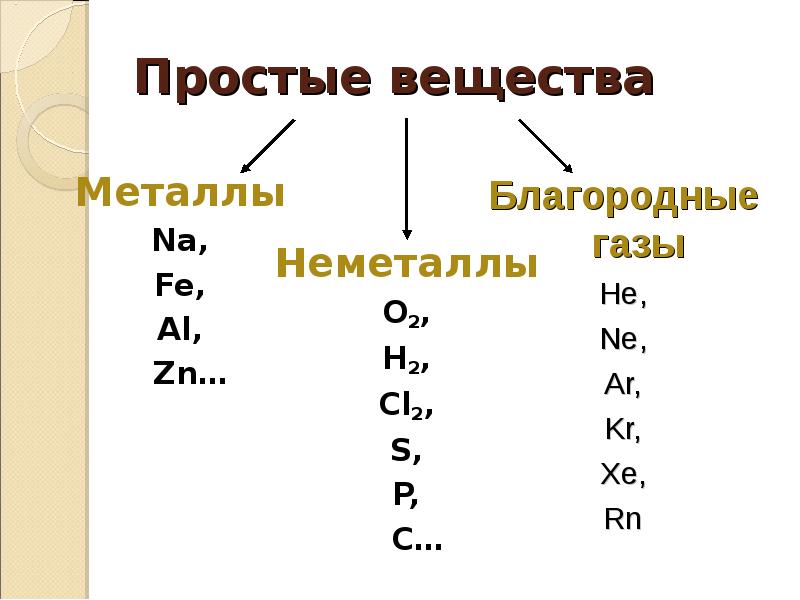
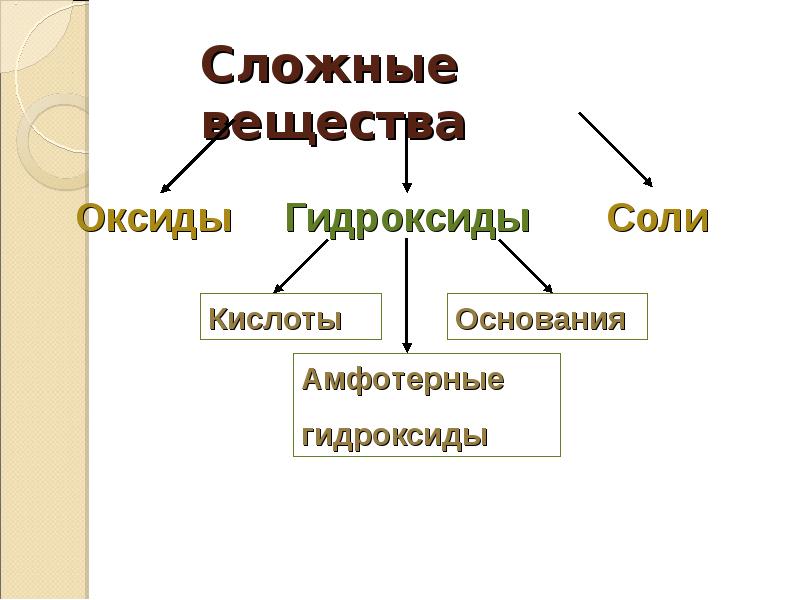


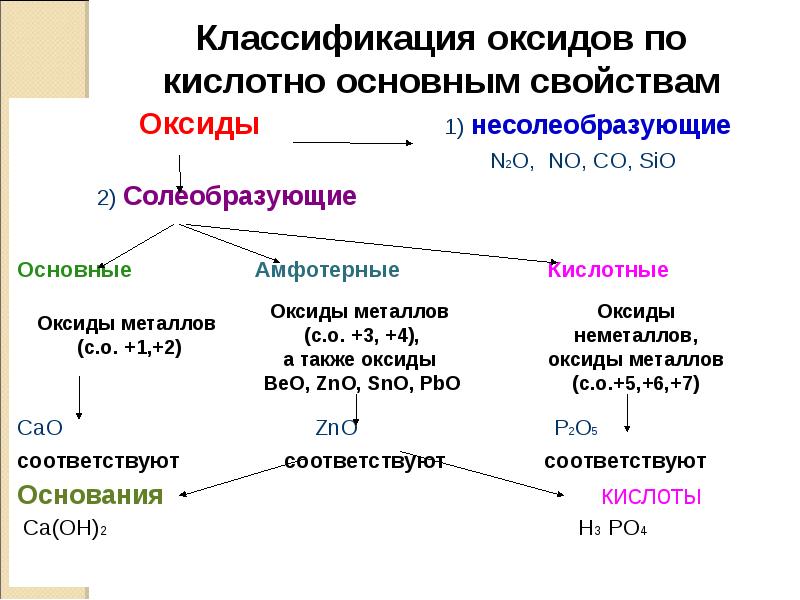


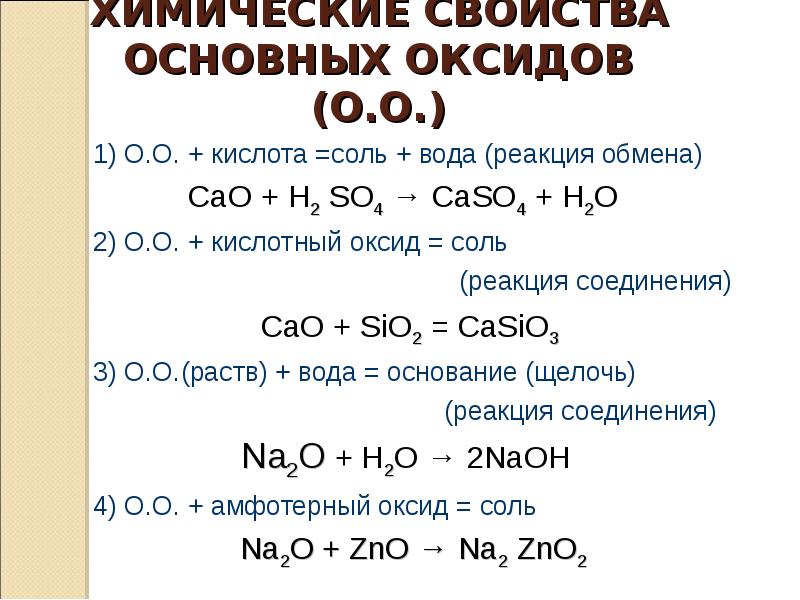





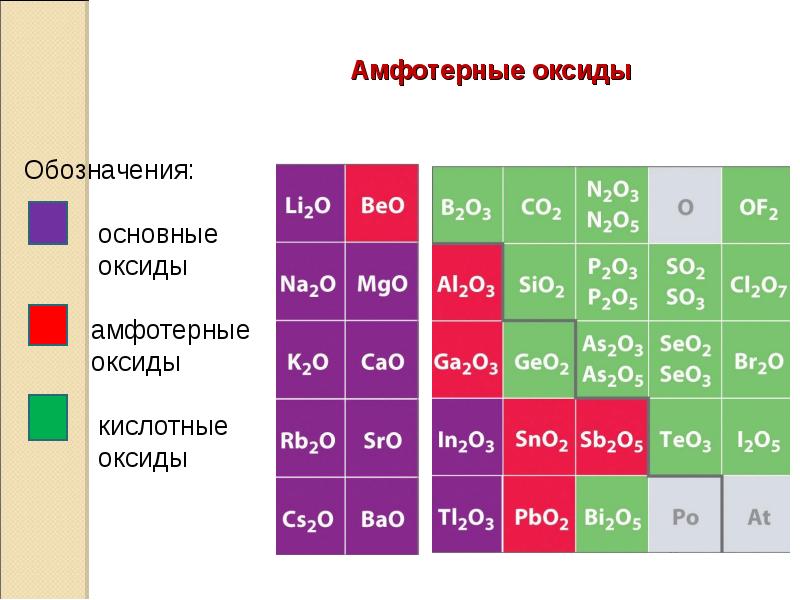
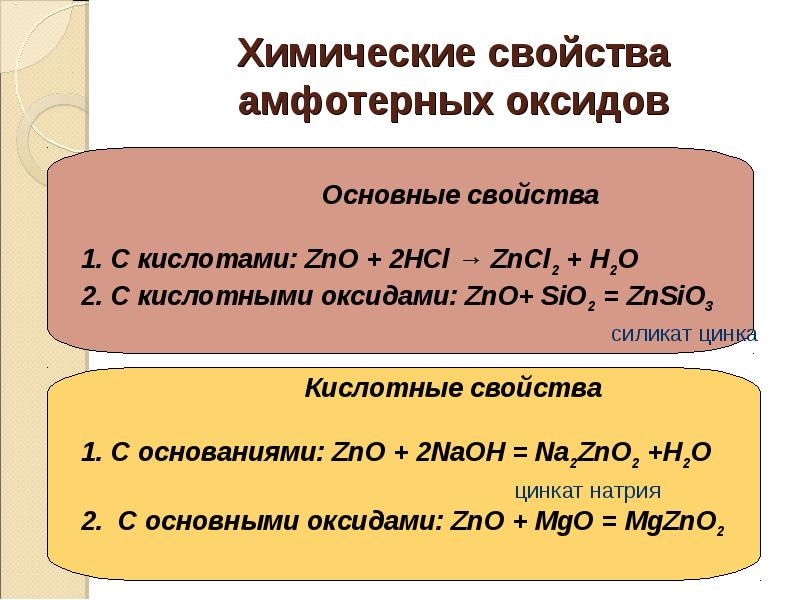



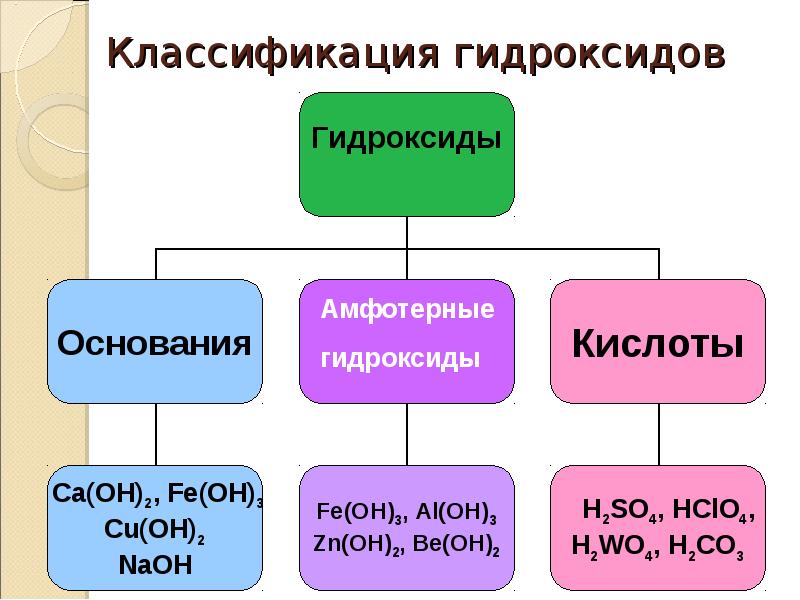

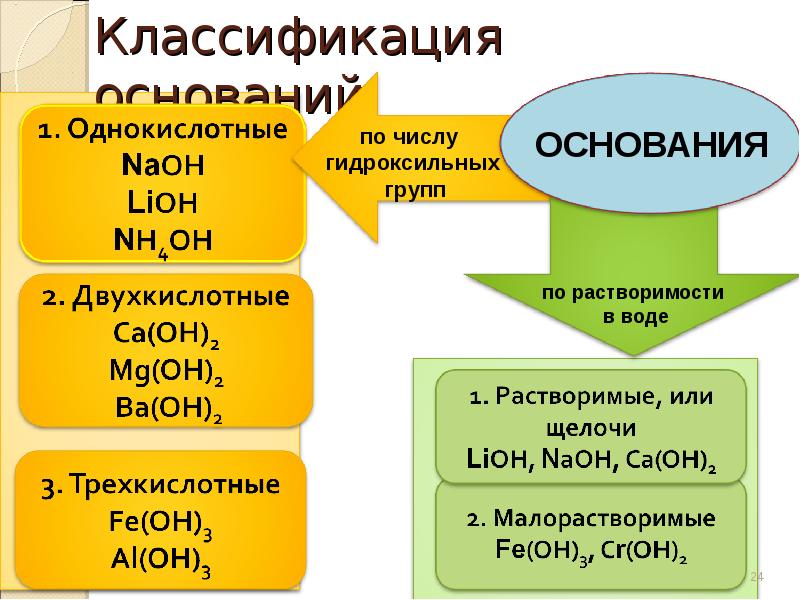







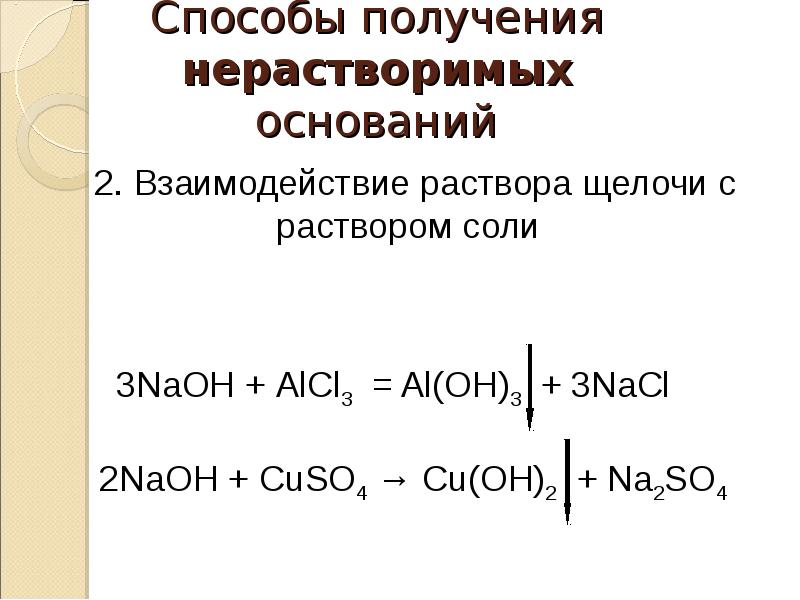



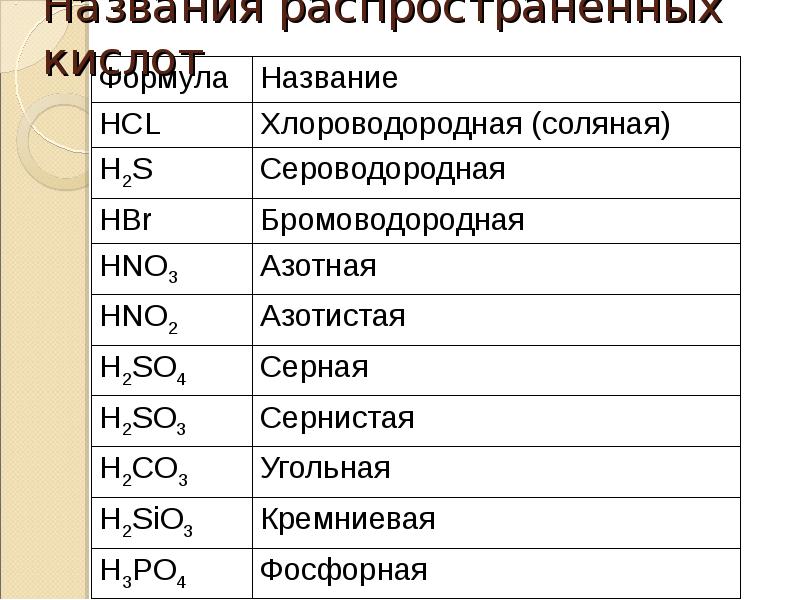




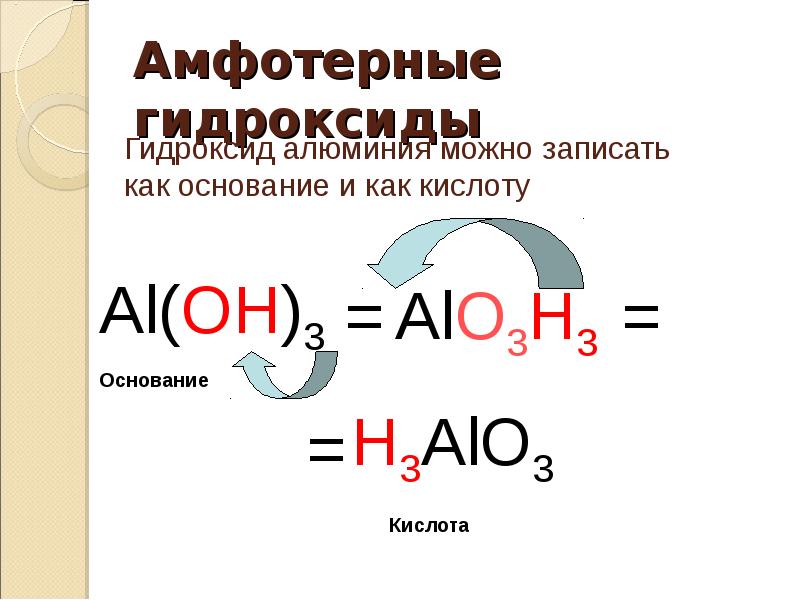
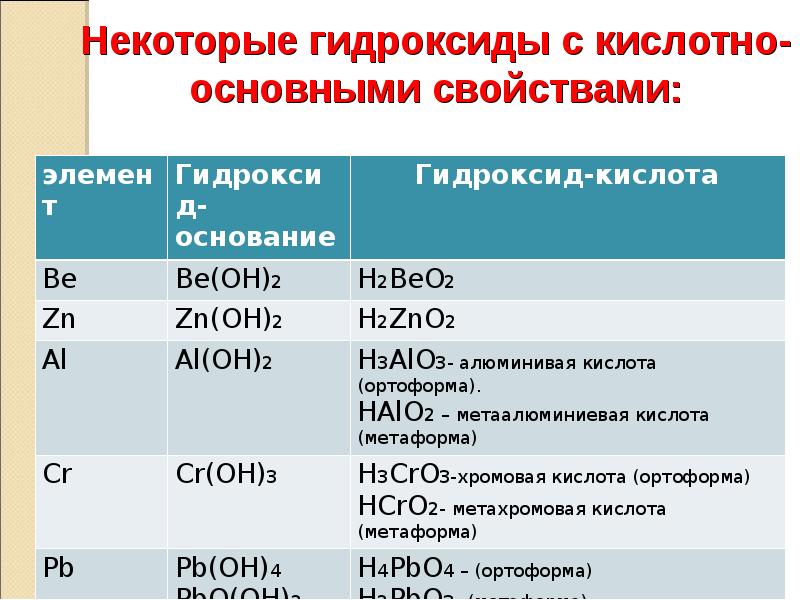
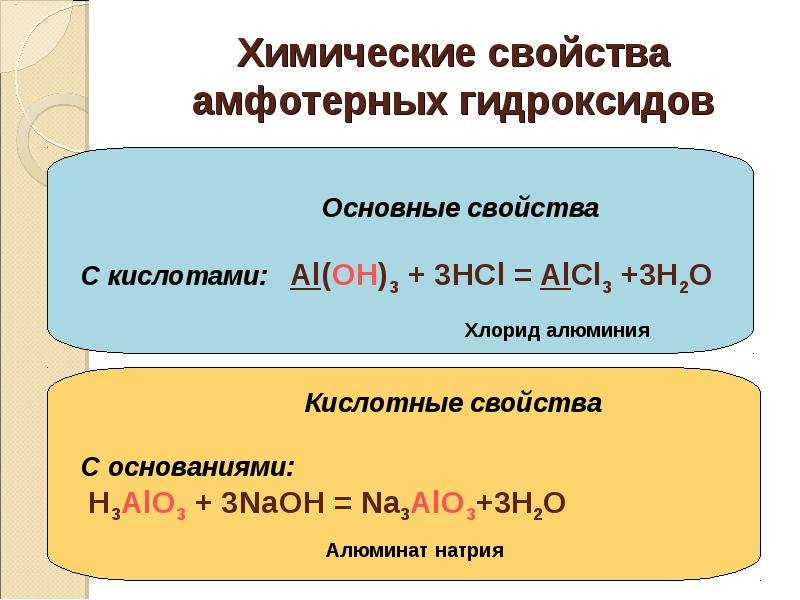


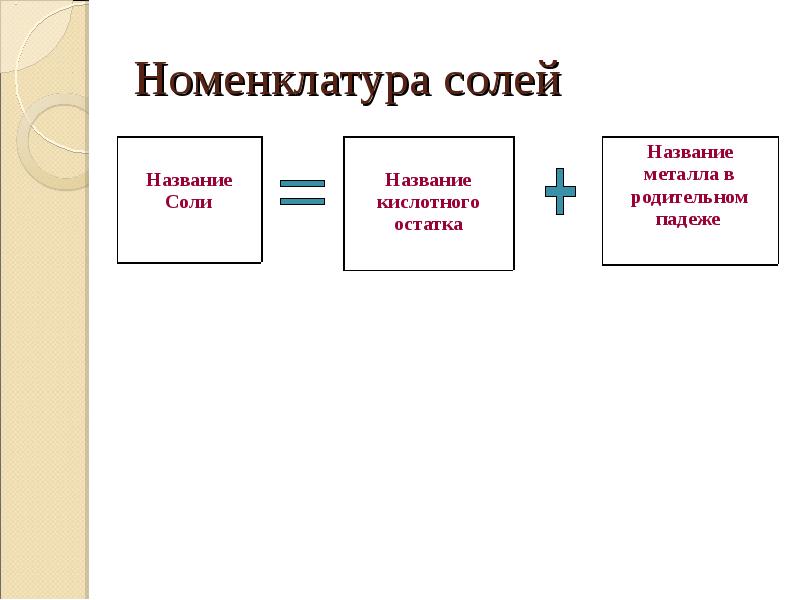





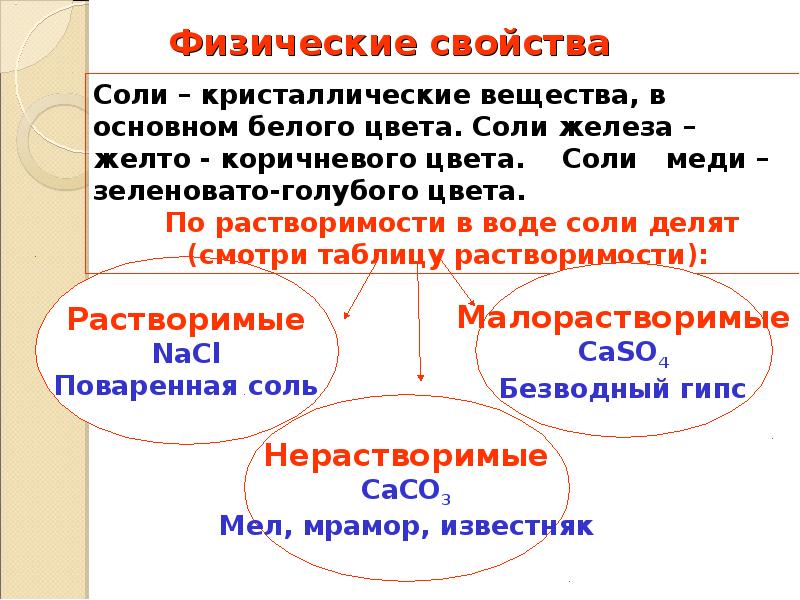
![Типы солей
Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы металла.
NaCl, Na2SO4, Na3PO4
Кислые - это соли, в которых атомы водорода замещены только частично.
NaHSO4, Na2HPO4, NaH2PO4
Основные - это соли, в которых группы ОН соответствующего основания частично замещены на кислотные остатки.
MgOHCl, Al(OH)2NO3
Двойные (смешанные) - это соли, в которых содержится два разных катиона и один анион.
KAl(SO4)2, Fe(NH4)2(SO4)2
Комплексные - это соли, в состав которых входит комплексный йон.
Na2[Zn(OH)4], K3[Fe(CN)6]](https://myslide.ru/documents_3/89461b5c6aa869cc6d1b20976cd6cfbb/img52.jpg)




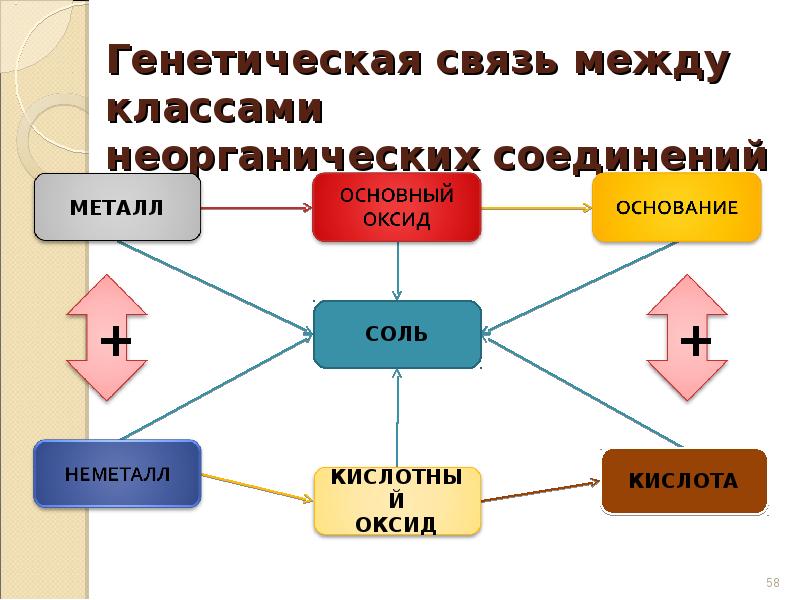





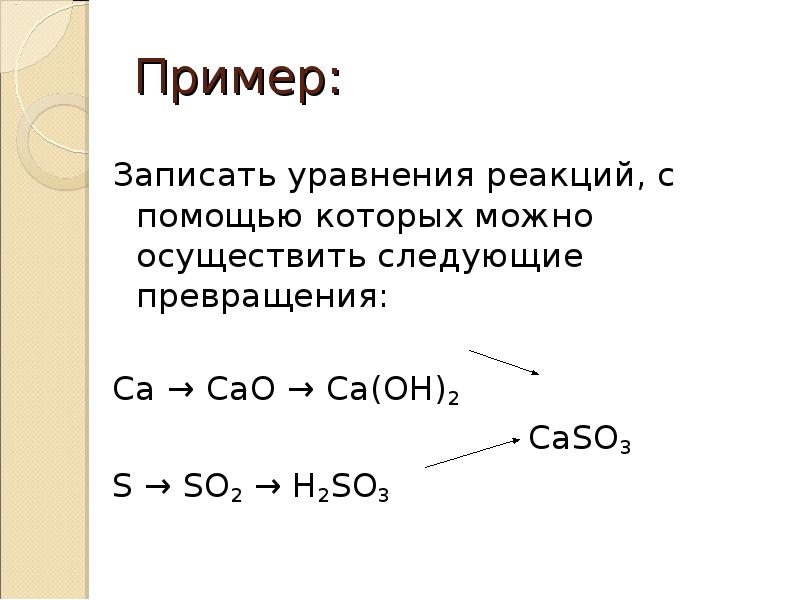


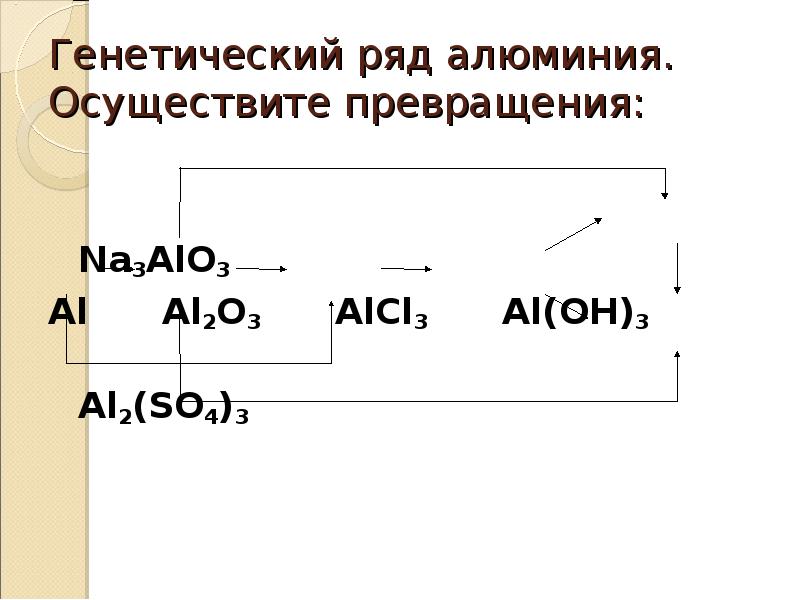




![Способы получения амфотерных гидроксидов
Осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента
AlCl3 + NаOH = Al(OH)3 + 3NаCl
ZnCl2 + 2KOH = Zn(OH)2 + 2KCl.
Существует опасность, что щелочь окажется в избытке:
ZnSO4 + 4NaOH(изб.) = Na2[Zn(OH)4] + Na2SO4](https://myslide.ru/documents_3/89461b5c6aa869cc6d1b20976cd6cfbb/img71.jpg)


