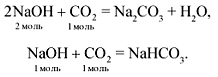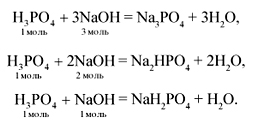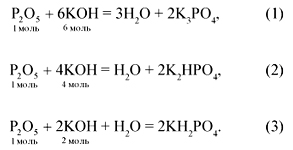в условии
в решении
в тексте к заданию
в атрибутах
Категория:
Атрибут:
Всего: 391 1–20 | 21–40 | 41–60 | 61–80 …
Добавить в вариант
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) сульфат железа(III)
Б) гидросульфат натрия
В) сульфид калия
Г) перхлорат бария
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) гидросульфат калия
Б) карбонат натрия
В) сульфат лития
Г) нитрат алюминия
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) гидрокарбонат натрия
Б) дихромат аммония
В) сульфат цинка
Г) нитрат бария
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) перхлорат кальция
Б) нитрат железа(III)
В) фосфат натрия
Г) гидрофторид калия
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) гидрофосфат натрия
Б) нитрат аммония
В) силикат калия
Г) бромат натрия
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между формулой соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) гидросульфид натрия
Б) хлорид магния
В) перхлорат кальция
Г) нитрит калия
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) карбонат калия
Б) гидрофосфат калия
В) сульфат аммония
Г) бромид кальция
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Расположите перечисленные ниже вещества в порядке увеличения pH их одномолярных растворов (от самого кислого к самому щелочному).
1)
2)
3)
4)
Запишите номера веществ в правильном порядке.
Показать
1
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) гидрокарбонат натрия
2) сульфат магния
3) сульфат натрия
4) соляная кислота
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
И с сильными кислотами, и со щелочами реагирует соль
1)
2)
3)
4)
Соль, которая реагирует с растворами щелочей:
1)
2)
3)
4)
Установите соответствие между названием соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СРЕДА РАСТВОРА
1) щелочная
2) нейтральная
3) кислая
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2019. Досрочная волна
Установите соответствие между названием соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) хлорид лития
Б) ацетат калия
В) хлорид меди
Г) сульфат аммония
СРЕДА РАСТВОРА
1) щелочная
2) нейтральная
3) кислая
Запишите в таблицу выбранные цифры под соответствующими буквами.
Источник: ЕГЭ по химии 2019. Основная волна. Вариант 1
Установите соответствие между названием соли и средой её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) хлорид алюминия
Б) нитрат цинка
В) сульфат калия
Г) гидрокарбонат натрия
СРЕДА РАСТВОРА
1) кислая
2) щелочная
3) нейтральная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: Демонстрационной версия ЕГЭ−2021 по химии
Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СРЕДА РАСТВОРА
1) кислая
2) нейтральная
3) щелочная
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Источник: ЕГЭ по химии 2021. Досрочная волна. Вариант 1
Установите соответствие между названием соли и характером среды её водного раствора.
НАЗВАНИЕ СОЛИ
А) карбонат калия
Б) нитрат алюминия
В) нитрат аммония
Г) сульфат натрия
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием соли и характером среды её водного раствора.
НАЗВАНИЕ СОЛИ
А) фосфат калия
Б) нитрат железа(III)
В) перманганат калия
Г) хлорид аммония
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием соли и характером среды её водного раствора.
НАЗВАНИЕ СОЛИ
А) нитрат магния
Б) сульфид натрия
В) дихромат калия
Г) сульфат железа (III)
ХАРАКТЕР СРЕДЫ
1) кислотная
2) щелочная
3) нейтральная
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
НАЗВАНИЕ СОЛИ
А) сульфат лития
Б) сульфат алюминия
В) хлорид аммония
Г) гидросульфид натрия
ХАРАКТЕР СРЕДЫ
1) нейтральная
2) кислотная
3) щелочная
Запишите в таблицу выбранные цифры под соответствующими буквами.
Всего: 391 1–20 | 21–40 | 41–60 | 61–80 …
Пройти тестирование по этим заданиям
Вернуться к каталогу заданий
Версия для печати и копирования в MS Word
1
Задания Д5 № 9
Среди перечисленных веществ:
А)
Б)
В)
Г)
Д)
Е)
кислыми солями являются
1) АДЕ
2) АВЕ
3) БДE
4) BДЕ
Источник: Демонстрационная версия ЕГЭ—2012 по химии
2
Задания Д5 № 151
Среди перечисленных веществ:
А)
Б)
В)
Г)
Д)
Е)
кислыми солями являются
1) АГД
2) АВЕ
3) БДE
4) BДЕ
Источник: Демонстрационная версия ЕГЭ—2013 по химии
3
Среди перечисленных веществ:
A)
Б)
B)
Г)
Д)
Е)
к основаниям относятся:
1) ABE
2) АБГ
3) ГДЕ
4) АГЕ
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 1
4
Среди перечисленных веществ:
A)
Б)
B)
Г)
Д)
Е)
кислыми солями являются:
1) БГЕ
2) БВЕ
3) АБГ
4) БГД
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 2
5
Среди перечисленных веществ:
A)
Б)
B)
Г)
Д)
Е)
к основаниям относятся:
1) ВГД
2) АБГ
3) АВГ
4) БГЕ
Источник: ЕГЭ по химии 10.06.2013. Основная волна. Дальний Восток. Вариант 3
Пройти тестирование по этим заданиям
Задачи на кислые и средние соли — это разновидность задач на альтернативные реакции, в которых в зависимости от соотношения количества вещества реагентов возможно протекание разных реакций и образование различных продуктов.
При взаимодействии щелочей с кислотными оксидами многоосновных кислот, либо с многоосновными кислотами возможно образование кислых или средних солей.
При избытке щелочи образуется средняя соль. При избытке кислоты или кислотного оксида образуется кислая соль. При этом возможно одновременное образование и кислой, и средней соли.
Рассмотрим взаимодействие углекислого газа и гидроксида натрия. При избытке гидроксида натрия образуется средняя соль и вода:
2NaOH(изб.) + CO2 = Na2CO3 + H2O (1)
При избытке углекислого газа образуется только кислая соль:
NaOH + CO2(изб.) = NaНCO3 (2)
Два варианта химических реакций, но пять возможных ситуаций расчетных задач с этими реакциями.
Отличительная особенность таких задач: при решении зачастую необходимо сравнить количества вещества реагентов, чтобы понять, какая именно (или какие) реакции протекают.
Ситуация 1. Избыток щелочи n(NaOH):n(CO2) > 2:1.
Например. Смешали 8 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 8:3 > 2:1
Количество вещества щелочи более чем в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
Гидроксид натрия в избытке, расчет ведем по недостатку, углекислому газу. В реакцию вступит 3 моль углекислого газа, и 6 моль гидроксида натрия:
nпрореаг.(NaOH) = 2n(CO2) = 6 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(СO2) = 3 моль
При этом остается гидроксид натрия:
nост.(NaOH) = 8 — 6 = 2 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль, n(NaOH) = 2 моль
Ситуация 2. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 2:1
Например. Смешали 6 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 2:1
Количество вещества щелочи ровно в два раза больше, чем количество вещества углекислого газа. Тогда протекает реакция 1:
2NaOH(изб.) + CO2 = Na2CO3 + H2O
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуются карбонат натрия и вода:
n(Na2CO3) = n(H2O) = n(СO2) = 1/2n(NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(Na2CO3) = n(H2O) = 3 моль
Ситуация 3. Избыток углекислого газа n(NaOH):n(CO2) > 1:1.
Например. Смешали 3 моль гидроксида натрия и 4 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 3:4 > 1:1
Количество вещества углекислого газа больше, чем количество вещества щелочи. Тогда протекает реакция 2:
NaOH + CO2(изб.) = NaHCO3
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 3 моль гидроксида натрия, и 3 моль углекислого газа:
nпрореаг.(СО2) = n(NaOH) = 3 моль
При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(NaOH) = 3 моль
При этом остается углекислый газ:
nост.(СО2) = 4 — 3 = 1 моль
Таким образом, после полного протекания реакции в системе присутствуют:
n(NaHCO3) = 3 моль, n(СO2) = 1 моль
Ситуация 4. Эквимолярное соотношение гидроксида натрия и углекислого газа n(NaOH):n(CO2) = 1:1
Например. Смешали 3 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 1:1
Количество вещества щелочи равно количеству вещества углекислого газа. Тогда протекает реакция 2:
NaOH + CO2(изб.)= NaHCO3
При эквимолярном соотношении реагентов оба реагента вступают в реакцию полностью. То есть ни один из реагентов ни в избытке, ни в недостатке. При этом образуется гидрокарбонат натрия:
n(NaHCO3) = n(СO2) = (NaOH) = 3 моль
Таким образом, после полного протекания реакции в системе присутствует:
n(NaHCO3) = 3 моль
Ситуации 1-4 — довольно стандартные. И, по сути, отличаются от обычных расчетных задач на избыток-недостаток только тем, что нужно определить, какая именно из двух реакций протекает. Ситуация 5 принципиально отличается.
Ситуация 5. Соотношение 1:1 < n(NaOH):n(CO2) < 2:1.
Например. Смешали 4 моль гидроксида натрия и 3 моль углекислого газа.
Соотношение n(NaOH):n(CO2) = 4:3, 1:1 < 4:3 < 2:1.
В такой ситуации образуются и карбонат натрия, и гидрокарбонат.
Решить такую задачу можно двумя способами — расчет через последовательно протекающие реакции и расчет через параллельно идущие реакции.
Метод последовательных реакций:
Пусть протекает реакция 1:
2NaOH + CO2 = Na2CO3 + H2O
Углекислый газ в избытке, расчет ведем по недостатку, по гидроксиду натрия. В реакцию вступит 4 моль гидроксида натрия, и 2 моль углекислого газа:
nпрореаг.(СО2) = 1/2n(NaOH) = 2 моль
При этом образуются карбонат натрия и вода:
n(Na2CO3) = 1/2n(NaOH) = 2 моль
Остается углекислый газ:
nост.(СО2) = 3 — 2 = 1 моль
Таким образом, после полного протекания реакции (1) в системе присутствуют:
n(Na2CO3) = n(H2O) = 2 моль, n(СO2) = 1 моль
Однако, оставшиеся вещества вступают в реакцию с образованием кислой соли:
Na2CO3 + H2O + СО2 = 2NaHCO3
При этом углекислый газ в недостатке, карбонат натрия в избытке. В реакцию вступают карбонат натрия:
nпрореаг.(Na2СО3) = n(CO2) = 1 моль
Образуется гидрокарбонат натрия:
n(NaHCO3) = 2n(CO2) = 2 моль,
Остается карбонат натрия:
nост.(Na2СО3) = 2 — 1 = 1 моль
Таким образом, после полного протекания последней реакции в системе присутствуют:
n(Na2CO3) = 1 моль, n(NaHСO3) = 2 моль
Метод параллельно идущих реакций:
Пусть одновременно протекают реакции (1) и (2):
2NaOH + CO2 = Na2CO3 + H2O (1)
NaOH + CO2 = NaНCO3 (2)
Пусть в первую реакцию вступает х моль СО2, во вторую реакцию у моль СО2.
Тогда в первую реакцию вступают 2х моль гидроксида натрия, во вторую реакцию у моль гидроксида натрия.
Получаем систему уравнений:
2х + y = 4
x + y = 3
Отсюда: x = 1 моль, у = 2 моль
n(Na2CO3) = 1/2n1(NaOH) = n1(CO2) = 1 моль
n(NaHCO3) = n2(NaOH) = n2(CO2) = 2 моль
Как видно, ответ не зависит от выбранного способа решения.
Примеры задач на кислые и средние соли из ЕГЭ по химии.
1. Через 228 г 3%-ного раствора гидроксида бария пропустили 1,21 л углекислого газа (н.у.), при этом углекислый газ поглотился полностью. Выпавший осадок отделили, а к оставшемуся раствору добавили 49 г 5%-ного раствора серной кислоты. Найдите массовую долю кислоты в образовавшемся растворе.
CO2 + Ba(OH)2 = BaCO3 + H2O
BaCO3 + CO2 + H2O = Ba(HCO3)2
Ba(HCO3)2 + H2SO4 = BaSO4 + 2CO2 + 2H2O
Ответ: w(H2SO4) = 0,4%
2. Газ, образовавшийся при гидролизе 36,4 г фосфида кальция, сожгли. К образовавшемуся при этом продукту последовательно добавили 100 мл воды и 50 мл раствора гидроксида натрия с массовой долей 25% и плотностью 1,28 г/см3. Определите состав образовавшейся соли и её массовую долю в растворе.
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
PH3 + 2O2 = H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 23,6%
3. При растворении 9,4 г оксида калия в воде получили раствор с массовой долей вещества 20%. К этому раствору добавили 98 г 20%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
K2O + H2O = 2KOH
KOH + H2SO4 = KHSO4 + H2O
Ответ: w(KHSO4) = 17,66%
4. При растворении 30,6 г оксида бария в воде получили раствор с массовой долей вещества 5%. К этому раствору добавили 98 г 40%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
BaO + H2O = Ba(OH)2
Ba(OH)2 + 2H3PO4 = Ba(H2PO4)2 + 2H2O
Ответ: w(Ba(H2PO4)2) = 8,465%
5. Газ, выделившийся при гидролизе 21 г нитрида лития, поглотили 545 мл 10%-ного раствора серной кислоты (плотностью 1,08 г/мл). Определите массовую долю соли в полученном растворе.
Li3N + 3H2O = 3LiOH + NH3
NH3 + H2SO4 = NH4HSO4
Ответ: w(NH4HSO4) = 11,52%
6. При растворении пероксида лития Li2O2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2,3 г пероксида лития в 62 г воды. Какой максимальный объём углекислого газа (н.у.) может быть поглощён получившейся щёлочью?
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiOH) = 3,8%, V(CO2) = 2,24 л
7. В 880 г 4%-ной серной кислоты растворили 16 г оксида серы(VI). К полученному раствору добавили 11,2 г гидроксида калия. Определите массу образовавшейся соли.
SO3 + H2O = H2SO4
H2SO4 + KOH = KHSO4 + H2O
Ответ: m(KHSO4) = 27,2 г
8. Серу массой 6,4 г сожгли в избытке кислорода. Полученный газ пропустили через 138 мл 8%-ного раствора гидроксида натрия (плотностью 1,087 г/мл). Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(Na2SO3) = 7,74%, w(NaHSO3) = 6,39%
9. Фосфор массой 1,55 г сожгли в избытке кислорода. Образовавшееся при этом вещество растворили в воде и полученный раствор прокипятили. К полученному раствору добавили 3,7 л 0,1%-ного раствора гидроксида кальция (плотностью 1 г/мл). Определите массу образовавшейся соли.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
Ответ: m(CaHPO4) = 6,8 г
10. Технический сульфат аммония массой 2,04 г, содержащий 3% примесей, нагревают с твёрдым гидроксидом натрия массой 1,6 г. Выделившийся в результате газ поглотили 29,4 г раствора с массовой долей фосфорной кислоты 10%. Вычислите массовую долю соли в образовавшемся растворе.
(NH4)2SO4 + 2NaOH = 2NH3 + Na2SO4 + 2H2O
H3PO4 + NH3 = NH4H2PO4
Ответ: w(NH4H2PO4) = 11,53%
11. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
2Na + 2H2O = 2NaOH + H2
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: w(Na2HPO4) = 13,6%
12. Оксид фосфора(V) массой 2,84 г растворили в 120 г раствора ортофосфорной кислоты с массовой долей 9% и полученный раствор прокипятили. К полученному раствору добавили 30 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
P2O5 + 3H2O = 2H3PO4
H3PO4 + NaOH = NaH2PO4 + H2O
Ответ: w(NaH2PO4) = 11,8%
13. При растворении пероксида лития Li2O2 в тёплой воде образуется гидроксид лития и выделяется газ. Раствором, полученным при действии 2,3 г пероксида лития на 62 г воды, поглотили 2,24 л (н.у.) углекислого газа. Вычислите массовую долю соли в полученном растворе.
2Li2O2 + 2H2O = 4LiOH + O2
LiOH + CO2 = LiHCO3
Ответ: w(LiHCO3) = 10,01%
14. Газ, выделившийся при гидролизе 16 г карбида кальция, сожгли. Газообразный продукт сгорания пропустили через 200 г 7%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
CaC2 + 2H2O = Ca(OH)2 + C2H2
2C2H2 + 5O2 = 4CO2 + 2H2O
CO2 + KOH = KHCO3
Ответ: m(KHCO3) = 25 г
15. 19,6 г оксида углерода(II) сожгли. Продукт сгорания полностью поглотили 420 г 10,5%-ного раствора гидроксида натрия. Найдите массовую долю веществ в полученном растворе.
2CO + O2 = 2CO2
CO2 + 2NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
Ответ: w(Na2CO3) = 9,4%, w(NaHCO3) = 5,6%
16. Образец натрия массой 0,92 г растворили в воде. Какую массу 10%‑ного раствора ортофосфорной кислоты нужно добавить к образовавшемуся раствору для получения гидроортофосфата натрия?
2Na + 2H2O = 2NaOH + H2
2NaOH + H3PO4 = Na2HPO4 + 2H2O
Ответ: m(раствора H3PO4) = 19,6 г
17. Смешали 120 г 4,1%-ного раствора ортофосфорной кислоты и 28 г 10%-ного раствора гидроксида калия. Найдите массу образовавшейся соли.
H3PO4 + KOH = KH2PO4 + H2O
Ответ: m(KH2PO4) = 6,8 г
18. Углекислый газ объёмом 560 мл (н.у.) полностью поглотили 1000 г раствора гидроксида кальция с массовой долей 0,15%. Найдите массу образовавшегося осадка и массовую долю соли в растворе.
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ответ: m(CaCO3) = 1,5 г, w(Ca(HCO3)2) = 0,08%
19. В избытке кислорода сожгли 8 г серы. Полученный газ пропустили через 200 г 8%-ного раствора гидроксида натрия. Определите массовые доли солей в полученном растворе.
S + O2 = SO2
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
Ответ: w(NaHSO3) = 4,8%, w(Na2SO3) = 8,75%
- Задачи на растворимость:
- Базовые знания (2 шт)
- Безводные соли (3 шт)
- Кристаллогидраты (4 шт)
- Задачи на кислые соли:
- Задачи (6 шт)
- Задачи на кристаллогидраты:
- Задача 1.
- Задача 2.
- Задача 3.
- Задача 4.
- Задачи на массовую долю и избыток-недостаток:
- Задача 1.
- Задача 2.
Задача 1. 16 г оксида серы (VI) растворили в 50 г 19,6% -ного раствора серной кислоты. В полученный раствор прибавили 16 г гидроксида натрия. Определите массу образовавшейся соли (солей).
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 29.
Ответ: m(NaHSO4) = 24 г, m(Na2SO4) = 14,2 г.
Решение (pdf файл)
Задача 2. Газ, полученный при взаимодействии 17,6 г сульфида железа (II) с избытком раствора серной кислоты, без остатка прореагировал с 138 мл 8% -ного раствора NaOH (плотность 1,087 г/мл). Определите состав полученного раствора и рассчитайте массовые доли веществ в этом растворе.
Источник: В.Н, Доронькин, Неорганическая Химия, Тренировочная тетрадь, стр. 28.
Ответ: w(NaHS) = 3,57% и w(Na2S) = 4,97%.
Решение (pdf файл)
Задача 3. Углекислый газ объемом 5,6 л (н.у.) пропустили через 164 мл 20%-ного раствора гидроксида натрия (плотность 1,22 г/мл). Определите состав и массовые доли веществ в полученном растворе.
Источник: Я сдам ЕГЭ, Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2CO3) = 12,6%, w(NaOH) = 9,48%.
Решение (pdf файл)
Задача 4. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе.
Источник: Я сдам ЕГЭ. Типовые задания, 2018 г, А.А. Каверина, стр. 207.
Ответ: w(Na2HPO4) = 13,6%.
Решение (pdf файл)
Задача 5. При гидролизе 7,28 г фосфида кальция образовался газ, который сожгли в избытке кислорода. Полученный оксид растворили в 41,65 мл 20% гидроксида калия (плотность 1,21 г/мл). Определите массы веществ (за исключением воды) в образующемся растворе.
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 48.
Ответ: m(K2HPO4) = 10,44 г, m(K3PO4) = 4,24 г.
Решение (pdf файл)
Задача 6. Оксид фосфора (V) массой 2,84 г растворили в 60 г 18%-ной ортофосфорной кислоты и полученный раствор прокипятили. Какая соль и в каком количестве образуется, если к полученному раствору добавить 30 г гидроксида натрия?
Источник: В.Н. Доронькин, «Неорганическая химия», Тренировочная тетрадь, стр. 49.
Ответ: m(Na3PO4) = 24,6 г.
Решение (pdf файл)
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль кислая
соль; например:
K2СО3 KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) :
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, 1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)• = 120 (г)•0,09 = 10,8 г.
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
(H3PO4)
= 1 +
2 = 0,11 + 0,04 = 0,15
моль.
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
(H3PO4)
: (NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M• = 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: (KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
(P2O5):
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
(P2O5):
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
(P2O5):
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P2O5)
= 0,1 моль.
m(KOH) = •m(р-ра)
= 0,084•200 (г) = 16,8 г,
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
(Р2О5):
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим (Р2О5)
в уравнении (2) как х моль, а (Р2О5) в уравнении (3)
как у моль, тогда потребуется: (KОН) = 4х + 2у.
Составим систему уравнений:
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
(P2O5)2
= 0,05 моль —> (K2НРО4)
= 0,1 моль,
(Р2О5)3
= 0,05 моль —> (KН2РО4)
= 0,1 моль.
Ответ: (K2НРО4) = 0,1 моль,
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, (Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, (NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ((NH4)2HPO4) = 43,8 %,
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат: