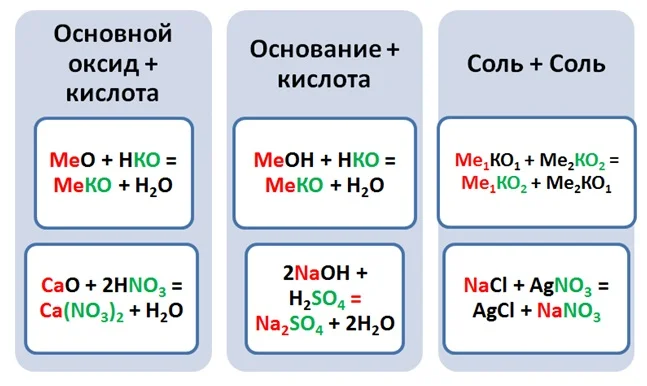
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли.
Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В
этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении
химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты
(в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются
исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными
оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль)
Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3,
Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и
кислотными оксидами, так и с основаниями и основными оксидами.
Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль)
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что
СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2,
SO3, P2O5, N2O3, NO2, N2O5, SiO2,
MnO3, Mn2O7.
Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять
степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой,
так как продукт реакции — H2SiO3 является нерастворимой кислотой.
Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
SO3 + H2O → H2SO4 (сохраняем СО серы +6)
SO2 + H2O → H2SO3 (сохраняем СО серы +4)

Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования.
К таким оксидам относят:
- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей.
Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов.
Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания
способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет.
Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH,
которое распадается на NH3 и H2O)
LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли
и воды, так и с основаниями — с образованием комплексных солей.
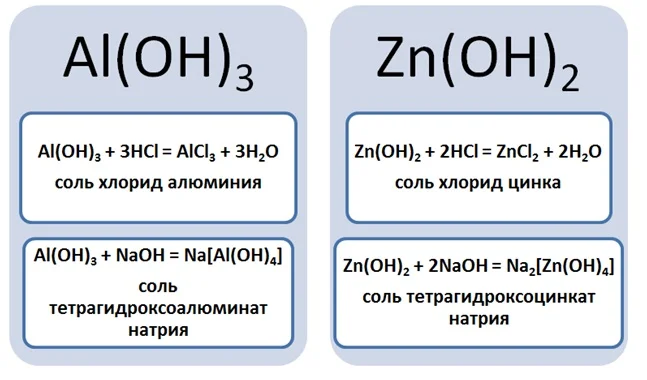
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких
температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации
кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней — часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 — двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию
с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную
и сернистую кислоты в разложившемся виде — виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз.
В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не
обманешь 
K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными
гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
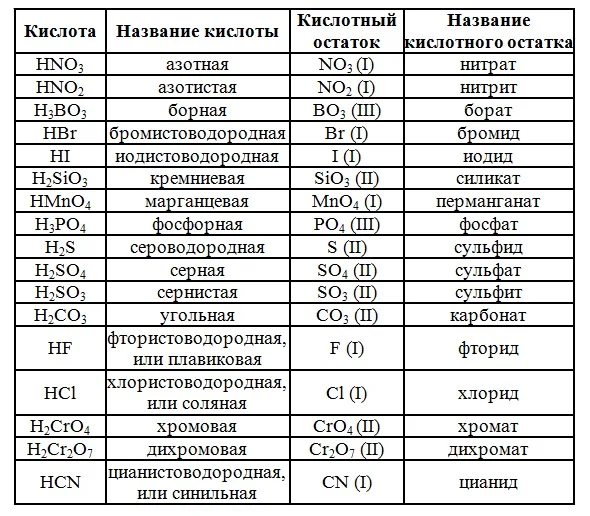
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается
металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат
лития, дигидрофосфат и гидрофосфат натрия) - Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4]
(тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более
активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)

Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в
избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода),
то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
MgCl2 + LiOH → Mg(OH)2↓ + LiCl
K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
Химические вещества можно разделить на две группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к какой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 31, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
Основные классы сложных веществ — это оксиды, гидроксиды, соли.
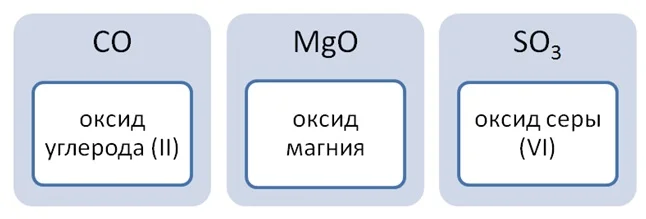
Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Солеобразующим оксидам соответствуют гидроксиды:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и разлагающиеся в воде.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из водорода H+ и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы: одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода кислоты бывают бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3 — распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
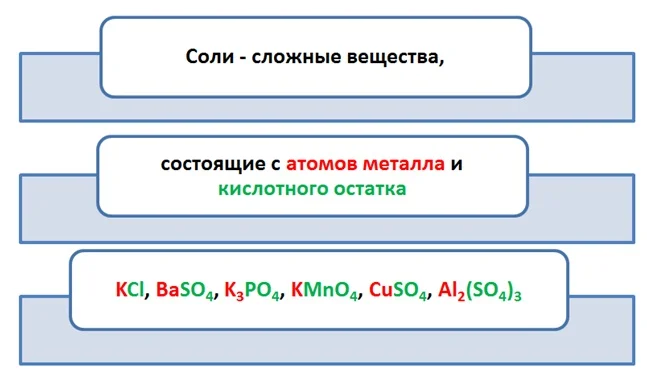
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4]Cl2).
Помимо основных классов неорганических соединений, существуют и другие.
Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
Тренировочный тест «Классификация неорганических веществ» 10 вопросов, при каждом прохождении новые.
202
Создан на
02 февраля, 2022 От Admin
Классификация неорганика
1 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) растворимому основанию,
Б) кислой соли,
В) несолеобразующему оксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
2 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) соли хлорной кислоты;
Б) щёлочи;
В) несолеобразующего оксида.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
3 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) одноосновной кислоте,
Б) несолеобразующему оксиду,
В) щёлочи.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
4 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) средней соли,
Б) кислотному оксиду,
В) двухосновной кислоте.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
5 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) амфотерному гидроксиду,
Б) средней соли,
В) двухосновной кислоте.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
6 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) растворимому основанию,
Б) кислой соли,
В) несолеобразующему оксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
7 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) смешанной соли;
Б) летучего водородного соединения;
В) несолеобразующего оксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
8 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) амфотерному оксиду,
В) двухосновной кислоте.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
9 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) средней соли,
В) амфотерному гидроксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
10 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) двойной соли;
Б) амфотерного гидроксида;
В) ангидрида кислоты.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Ваша оценка
The average score is 57%
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
2.1. Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH3, серная кислота H2SO4, гашеная известь Ca(OH)2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как ЭxOy, где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe2O3 — оксид железа (III); CuO — оксид меди (II); N2O5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N2O5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na2O — оксид натрия; H2O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие.
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N2O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N2O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr2O3 и кислотный оксид CrO3.
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH)x, где x чаще всего равен 1 или 2.
Исключения: Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH)2, соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH)2 — гидроксид железа (II),
Cu(OH)2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH)2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как HxA, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H2SO4, HCl, HNO3, HNO2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты: HF, HCl, HBr, HI, HNO3;
— двухосновные кислоты: H2SO4, H2SO3, H2CO3;
— трехосновные кислоты: H3PO4, H3AsO4.
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH3COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H2SO4, HNO3, H3PO4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами.
Более детально про классификацию кислот можно почитать здесь.
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H2S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl— — хлорид, Br— — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H2S+6O4, хромовая кислота H2Cr+6O4.
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH)2, Zn(OH)2, Sn(OH)2 и Pb(OH)2, несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH)3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
| Амфотерный гидроксид в форме основания | Амфотерный гидроксид в форме кислоты | «Кислотный» остаток |
| Zn(OH)2 гидроксид цинка | H2ZnO2 цинковая кислота | ZnO22- цинкат |
| Al(OH)3 (орто)гидроксид алюминия | H3AlO3 ортоалюминиевая кислота | AlO33- ортоалюминат |
| AlO(OH) метагидроксид алюминия | HAlO2 метаалюминиевая кислота | AlO2— метаалюминат |
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO3)2, NaHCO3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH4)2SO4 (сульфат аммония), [CH3NH3]+Cl— (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H+ в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na2SO4, а при полном замещении гидроксид-ионов в основании Ca(OH)2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO3)2.
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO4.
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют основными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH)2 на нитрат-ионы образуется основная соль Ca(OH)NO3.
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями. Так, например, двойными солями являются KNaCO3, KMgCl3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na2[Zn(OH)4] и Na[Al(OH)4] соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H+, а из анионов должны быть какие-либо анионы помимо (или вместо) OH—. Так, например, соединение H2[SiF6] не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H+. По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение [Ag(NH3)2]OH, т.к. данное соединение состоит из катионов [Ag(NH3)2]+ и гидроксид-ионов OH—, т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na2SO4 — сульфат натрия;
NaHSO4 — гидросульфат натрия;
CaCO3 — карбонат кальция;
Ca(HCO3)2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH)2CO3 — гидроксокарбонат меди (II);
Fe(OH)2NO3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
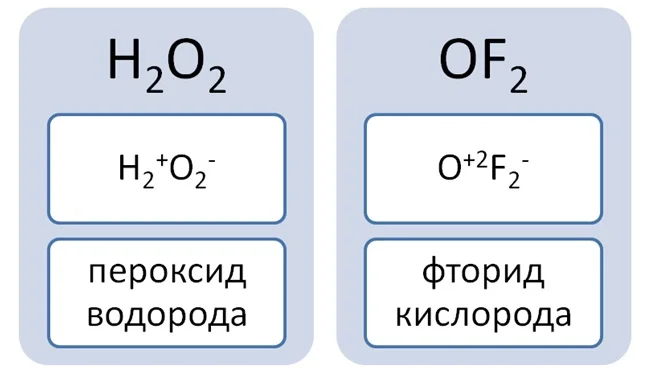
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Источник
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
Химические свойства оснований и амфотерных гидроксидов
Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп ($–OH$).
Общая формула ${Me}↖{+y}(OH)_y$,где $y$ — число гидроксогрупп, равное степени окисления металла ${Me}↖{+y}$.
Классификация оснований.
| Признаки классификации | Группы оснований | Примеры |
| Растворимость в воде | растворимые (щелочи) | $NaOH, KOH, Ca(OH)_2, Ba(OH)_2$ |
| нерастворимые | $Cu(OH)_2, Fe(OH)_2, Fe(OH)_3$ | |
| Степень электролитической диссоциации | сильные ($α→1$) | щелочи |
| слабые ($α→0$) | нерастворимые основания, водный р-р аммиака $NH_3·H_2O$ | |
| Кислотность (число гидроксогрупп) | однокислотные | $NaOH, KOH$ |
| двухкислотные | $Fe(OH)_2, Cu(OH)_2$ |
Свойства щелочей — гидроксидов щелочных и щелочноземельных металлов
1. Водные растворы щелочей мылкие на ощупь, изменяют окраску индикаторов: лакмуса — в синий цвет, фенолфталеина — в малиновый.
2. Водные растворы диссоциируют:
$Ba(OH)_2=Ba_^{2+}+2OH^–$.
3. Взаимодействуют с кислотами, вступая в реакцию обмена:
$NaOH+HCl=NaCl+H_2O$ — реакция нейтрализации.
Многокислотные основания могут давать средние и основные соли:
$Ca(OH)_2+HCl=CaOHCl+H_2O$.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
$Ca(OH)_2+CO_2=CaCO_3↓+H_2O$,
$NaOH+CO_{2(изб.)}=NaHCO_3$.
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
а) сплавление:
$2NaOH+ZnO=Na_2ZnO_2+H_2O$,
$2NaOH+Zn(OH)_2=Na_2ZnO_2+2H_2O;$
б) в растворах:
$2KOH+H_2O=ZnO+K_2[Zn(OH)_4]$,
$2KOH+Zn(OH)_2=K_2[Zn(OH)_4]$.
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
$2NaOH+CuSO_4=Cu(OH)_2↓+Na_2SO_4$,
$NaOH+NH_4Cl=NH_3↑+H_2O+NaCl$.
Нерастворимые основания ($Cr(OH)_3, Mn(OH)_2$ и др.) взаимодействуют с кислотами и разлагаются при нагревании:
$Mn(OH)_2+2HCl=MnCl_2+2H_2O$,
$Mn(OH)_2{→}↖{t}MnO+H_2O$.
Амфотерные оксиды и гидроксиды.
| $H_2ЭO_2$ Кислотная форма |
—-$ЭO$—- $BeO, ZnO, GeO, SnO, PbO, …$ |
$Э(OH)_2$ Основная форма |
| $H_3ЭO_3$ Кислотная ортоформа $НЭO_2$ Кислотная метаформа |
—-$Э_2O_3$—- $Al_2O_3, Ga_2O_3, In_2O_3, Tl_2O_3,$ $Cr_2O_3, Fe_2O_3, Sb_2O_3, …$ |
$Э(OH)_3,$ чаще $Э_2O_3·nH_2O,ЭO(OH)$ Основная форма |
| $H_4ЭO_4$ Кислотная ортоформа $Н_2ЭO_3$ Кислотная метаформа |
—-$ЭO_2$—- $GeO_2,SnO_2, PbO_2, VO_2, TiO_2, …$ |
$Э(OH)_4,$ чаще $ЭO·nH_2O,ЭO(OH)_2$ Основная форма |
Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
$Zn(OH)_2+2HCl=ZnCl_2+2H_2O$.
2. Взаимодействуя со щелочами — сильными основаниями, они обнаруживают кислотные свойства:
$Zn(OH)_2+2NaOH=Na_2[Zn(OH)_4]$ — комплексная соль;
$Al(OH)_3+NaOH=Na[Al(OH)_4]$ — комплексная соль.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
Химические свойства кислот
Кислотами называются сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Классификация кислот.
В обычных условиях кислоты могут быть твердыми (фосфорная $H_3PO_4$; кремниевая $H_2SiO_3$) и жидкими (в чистом виде жидкостью является серная кислота $H_2SO_4$).
Такие газы, как хлороводород $HCl$, бромоводород $HBr$, сероводород $H_2S$, в водных растворах образуют соответствующие кислоты.
Разделение кислот на группы по различным признакам представлено в таблице.
Классификация кислот.
| Признаки классификации | Группы кислот | Примеры |
| Наличие кислорода в кислотном остатке | а) кислородные б) бескислородные |
$H_3PO_4, HNO_3$ $H_2S, HCl, HBr$ |
| Основность | а) одноосновные б) двухосновные в) трехосновные |
$HCl, HNO_3$ $H_2S, H_2SO_4$ $H_3PO_4$ |
| Растворимость в воде | а) растворимые б) нерастворимые |
$H_2SO_4, H_2S, HNO_3$ $H_2SiO_3$ |
| Летучесть | а) летучие б) нелетучие |
$H_2S, HCl, HNO_3$ $H_2SO_4, H_2SiO_3, H_3PO_4$ |
| Степень электролитической диссоциации | а) сильные б) слабые |
$H_2SO_4, HCl, HNO_3$ $H_2S, H_2SO_3, H_2CO_3$ |
| Стабильность | а) стабильные б) нестабильные |
$H_2SO_4, H_3PO_4, HCl$ $H_2SO_3, H_2CO_3, H_2SiO_3$ |
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, т.е. испаряются. Например, соляная кислота является летучей, но устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота разлагается на воду и $SiO_2$.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водный раствор хромовой кислоты $H_2CrO_4$ имеет желтую окраску, марганцевой кислоты $HMnO_4$ — малиновую.
Свойства кислот
Кислый вкус, воздействие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
$HCl=H^{+}+Cl^–$,
$HNO_3=H^{+}+NO_3^{-}$,
$H_2SO_4=H^{+}+HSO_4^{-}⇄2H^{+}+SO_4^{2-}$.
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли:
$2HCl+Zn=ZnCl_2+H_2↑$,
$2H^{+}+Zn=Zn^{2+}+H_2↑$.
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
$2HCl+ZnO=ZnCl_2+H_2O$,
$2H^{+}+ZnO=Zn^{2+}+H_2O$.
4. И те, и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовывать как средние, так и кислые соли (это реакции нейтрализации):
а) $H^{+}+OH^{–}=H_2O$.
Например, $HCl+NaOH=H_2O+NaCl;$
б) $H_2SO_4+NaOH={NaHSO_4}↙{text»кислая соль»}+H_2O$.
5. Реакция между кислотами и солями идет только в том случае, если образуется осадок или газ:
$2H^{+}+CaCO_3=Ca^{2+}+H_2O+CO_2↑,$
$SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Взаимодействие $H_3PO_4$ с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка $Ca_3(PO_4)_2$.
Особенности свойств азотной $HNO_3$ и концентрированной серной $H_2SO_4$(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы $H^+$, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород $H_2$, а другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры).
Следует отметить, что третий продукт реакции металлов с этими кислотами образуется в «букете » — смеси с другими продуктами. Эти особенности химического поведения $HNO_3$ и $H_2SO_4$(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ.
Продукты взаимодействия простых веществ с азотной и серной кислотами.
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Mg$ | $Al$ | $Zn$ | $Fe$ |
| $HNO_3$ разбавленная |
$Mg(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Al(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Zn(NO_3)_2$ $NH_4NO_3$ $N_2$ |
$Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
| $HNO_3$ концентрированная |
$Mg(NO_3)_2$ $N_2O$ |
пассивирует | $Zn(NO_3)_2$ $N_2O$ |
пассивирует |
| $H_2SO_4$ разбавленная |
$MgSO_4$ $H_2$ |
$Al_2(SO_4)_3$ $H_2$ |
$ZnSO_4$ $H_2$ |
$FeSO_4$ $H_2$ |
| $H_2SO_4$ концентрированная горячая |
$MgSO_4$ $H_2S$ |
$Al_2(SO_4)_3$ $H_2S$ |
$ZnSO_4$ $H_2S$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ $S$ |
| ${text»Простые вещества»}/{text»Кислоты»}$ | $Cr$ | $Cu$ | $P$ | $S$ |
| $Fe(NO_3)_3$ $NH_4NO_3$ $N_2$ |
$Cr(NO_3)_3$ $NO$ |
$Cu(NO_3)_2$ $NO$ |
$H_3PO_4$ $NO$ |
$H_2SO_4$ $NO$ |
| пассивирует | пассивирует | $Cu(NO_3)_2$ $N_2O$ |
$H_3PO_4$ $N_2O$ |
$H_2SO_4$ $N_2O$ |
| $FeSO_4$ $H_2$ |
$CrSO_4$ $H_2$ |
— | — | — |
| $Fe_2(SO_4)_3$ $SO_2$ $S$ |
$Fe_2(SO_4)_3$ $SO_2$ |
$CuSO_4$ $SO_2$ |
$H_3PO_4$ $SO_2$ |
$SO_2$ $H_2O$ |
Химические свойства солей: средних, кислых, основных, комплексных
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Номенклатура солей
Названия солей кислородсодержащих кислот состоят из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла — в родительном. Названия ионов кислотных остатков составляются, в свою очередь, из корней названий элементов с суффиксами -ат для высшей степени окисления и -ит для низшей степени окисления атомов элемен — та-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты $HNO_3$ называются нитратами: $KNO_3$ — нитрат калия, а соли азотистой кислоты $HNO_2$ — нитритами: $Ca(NO_2)_2$ — нитрит кальция. Если же металл проявляет различные степени окисления, то они указываются в скобках римской цифрой, например: $Fe^{2+}SO_4$ — сульфат железа (II) и $Fe_2^{3+}(SO_4)_3$ — сульфат железа (III).
Номенклатура солей.
| Название кислоты | Формула | Название солей | Формула (пример) |
| Азотистая | $HNO_2$ | Нитриты | $KNO_2$ |
| Азотная | $HNO_3$ | Нитраты | $Al(NO_3)_3$ |
| Хлороводородная (соляная) | $ HCl$ | Хлориды | $FeCl_3$ |
| Сернистая | $ H_2SO_3$ | Сульфиты | $K_2SO_3$ |
| Серная | $H_2SO_4$ | Сульфаты | $Na_2SO_4$ |
| Сероводородная | $H_2S$ | Сульфиды | $FeS$ |
| Фосфорная | $H_3PO_4$ | Фосфаты | $Ca_3(PO_4)_2$ |
| Угольная | $H_2CO_3$ | Карбонаты | $CaCO_3$ |
| Кремниевая | $H_2SiO_3$ | Силикаты | $Na_2SiO_3$ |
Растворимость солей
По растворимости в воде соли делятся на растворимые ($Р$), нерастворимые ($Н$) и малорастворимые ($М$). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты — нитраты.
- Растворимы все соли соляной кислоты — хлориды, кроме $AgCl (Н), PbCl_2 (М)$.
- Растворимы все соли серной кислоты — сульфаты, кроме $BaSO_4 (Н), PbSO_4 (Н)$.
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей для $Na^{+}$ и $K^{+}$.
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
$Na_2CO_3$ — карбонат натрия,
$CuSO_4$ — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
$Na_2CO_3=2Na^{+}+CO_2^{2-}$.
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду $NaHCO_3$, которая состоит из катиона металла $Na^{+}$ и кислотного однозарядного остатка $HCO_3^{−}$. Для кислой кальциевой соли формула записывается так: $Ca(HCO_3)_2$.
Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
$Mg(HSO_4)_2$ — гидросульфат магния.
Диссоциируют кислые соли следующим образом:
$NaHCO_3=Na^{+}+HCO_3^{-}$,
$Mg(HSO_4)_2=Mg^{2+}+2HSO_4^{-}$.
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит $(CuOH)_2CO_3$, о котором вы читали в сказках П. Бажова. Он состоит из двух основных катионов $CuOH^{+}$ и двухзарядного аниона кислотного остатка $CO_3^{2−}$.
Катион $CuOH^{+}$ имеет заряд $+1$, поэтому в молекуле два таких катиона и один двухзарядный анион $CO_3^{2−}$ объединены в электронейтральную соль.
Названия этих солей такие же, как и у нормальных солей, но с прибавлением приставки гидроксо-, $(CuOH)_2CO_3$ — гидро ксокарбонат меди (II) или $AlOHCl_2$ — гидроксо хлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
$AlOHCl_2=AlOH^{2+}+2Cl^{–}$.
Свойства солей
Типичные реакции солей.
1. Соль + кислота ${→}↙{text»(реакция обмена)»}$ другая соль + другая кислота.
2. Соль + щелочь ${→}↙{text»(реакция обмена)»}$ другая соль + другое основание.
3. ${Соль_1 + соль_2 → соль_3 + соль_4}↙{text»(реакция обмена: в реакцию вступают две соли, в результате ее получаются две другие соли)»}$.
4. Соль + металл ${→}↙{text»(реакция замещения)»}$ другая соль + другой металл.
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
а) $Ca(NO_3)_2+Na_2CO_3=CaCO_3↓+2NaNO_3$
или $Ca^{2+}+CO_2^{2-}=CaCO_3↓$;
б) $K_2SO_4+BaCl_2=2KCl+BaSO_4↓$
или $SO_4^{2-}+Ba^{2+}=BaSO_4↓$.
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов.
Второе правило ряда напряжений: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило соблюдается при выполнении следующих условий:
а) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
б) металлы не должны взаимодействовать с водой, по этому металлы главных подгрупп I и II групп (для последней начиная с $Са$) не вытесняют другие металлы из растворов солей.
Комплексные соединения
При взаимодействии со щелочами амфотерных оксидов и гидроксидов в растворе образуются комплексные соли, состав которых может быть отражен формулой
${Na[Al(OH)_4^{–}]}↙{text»тетрагидроксоалюминат натрия»}$.
Комплексными называют соединения, в которых хотя бы одна ковалентная связь образовывалась по донорно-акцепторному механизму.
В переводе с латинского complexus означает «сочетание». Действительно, очень многие комплексные соединения получают из двух или трех веществ, например:
$NH_3 + HCl = {[NH_4]Cl}↙{text»соль аммония»}$,
$C_6H_5NH_2 + HCl = {[C_6H_5NH_3]}↙{text»соль амина»}$.
Малорастворимый гидроксид алюминия под воздействием гидроксид-ионов $ОН^{–}$ переходит в раствор в виде иона $[Al(OH)_4]^{–}$:
$Al(OH)_3 + OH^{–} = [Al(OH)_4]^{–}$.
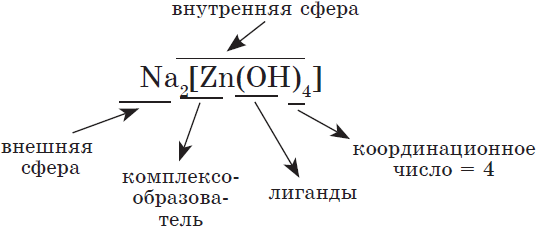
Комплексные, или, как их еще называют, координационные соединения, построены так: в центре находится атом или ион (он называется комплексообразователем), а вокруг него — атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму (называются лигандами). Это могут быть анионы кислот, молекулы небольшого размера ($H_2O, NH_3, CO$), имеющие атомы с неподеленными электронными парами.
Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Последнее изменяется от $1$ до $12$ (но чаще атом образует внутреннюю сферу комплекса (ее заключают в квадратные скобки). Внешняя сфера состоит из ионов, не связанных непосредственно с комплексообразователем. Внутренняя сфера участвует в химических реакциях как один многоатомный ион, внешняя сфера — как обычные ионы.
Например, строение тетрагидроксоалюмината натрия:
и уравнение его диссоциации:
$Na_2[Zn(OH)_4]→2Na^{+}+[Zn(OH)_4]^{2–}$.
Комплексные соединения играют большую роль в жизнедеятельности живых организмов. Почти все ферменты, гормоны, хлорофилл растений и гемоглобин животных, лекарства представляют собой комплексные соединения.
Электролитическая диссоциация в водных растворах. Слабые и сильные электролиты
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый Сванте Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него, русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т.е. «одетые в шубку» из молекул воды.
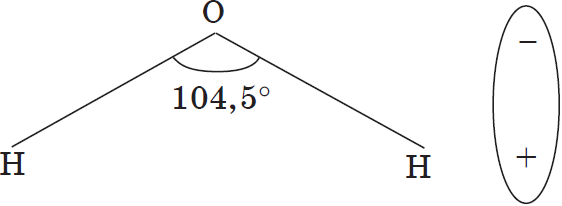
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом $104.5°$, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
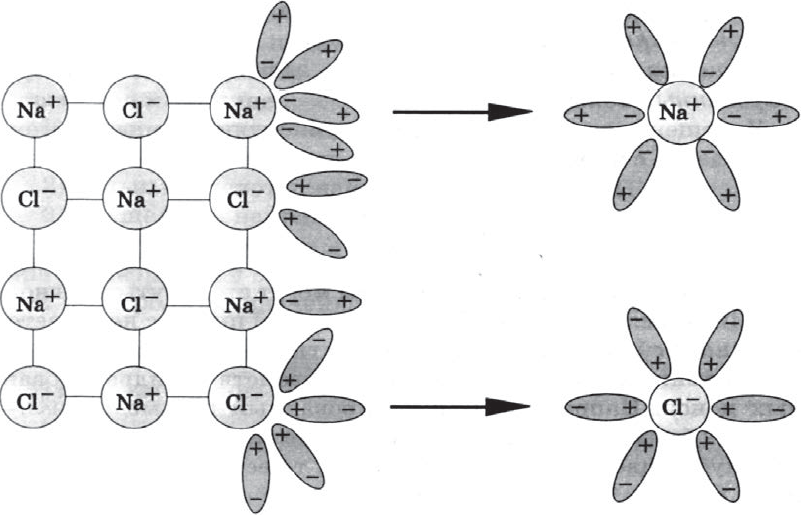
Как правило, легче всего диссоциируют вещества с ионной связью и соответственно с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), такова:
а) ориентация молекул (диполей) воды около ионов кристалла;
б) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
в) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с по мощью следующего уравнения:
$NaCl=Na^{+}+Cl^{–}$.
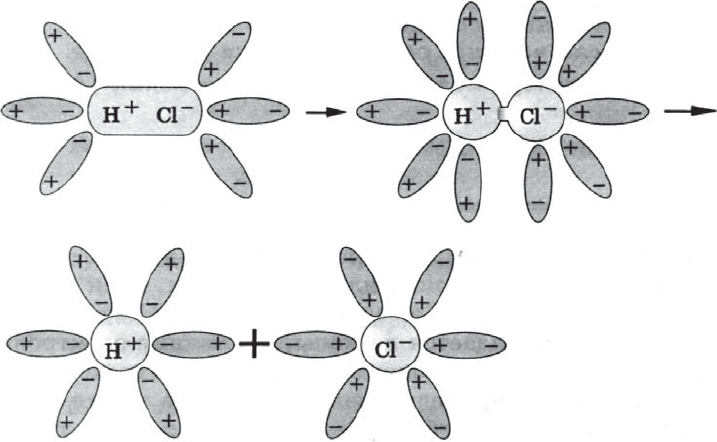
Аналогично диссоциируют и электролиты, в молекулах которых — ковалентная связь (например, молекулы хлороводорода $HCl$); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную и последовательность процессов, происходящих при этом, такова:
а) ориентация молекул воды вокруг полюсов молекул электролита;
б) гидратация (взаимодействие) молекул воды с молекулами электролита;
в) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
г) диссоциация (распад) молекул электролита на гидратированные ионы.
Упрощенно уравнение диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
$HCl=H^{+}+Cl^{–}$.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди $Cu^{2+}$ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т.е. связан с молекулами воды $Cu^{2+}·nH_2O$. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой $α$ (альфа).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы ($N_g$), к общему числу растворенных частиц ($N_р$):
$α={N_g}/{N_p}$.
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если $α=0$, то диссоциация отсутствует, а если $α=1$, или $100%$, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т.е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: $H_2SO_4, HCl, HNO_3$;
3) все щелочи, например: $NaOH, KOH$.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) слабые кислоты — $H_2S, H_2CO_3, HNO_2$;
2) водный раствор аммиака $NH_3·H_2O$;
3) вода;
4) некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
$CH_3COOH⇄H^{+}+CH_3COO^{–}$,
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
$K_{равн.}={[H^{+}]·[CH_3COO^{-}]}/{[CH_3COOH]}$
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия $Na0$ энергично взаимодействуют с водой, образуя при этом щелочь ($NaOH$) и водород $Н_2$, в то время как ионы натрия $Na^{+}$ таких продуктов не образуют. Хлор $Cl_2$ имеет желто-зеленый цвет и резкий запах, ядовит, а ионы хлора $Cl^{–}$ бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
По составу ионы делятся на простые — $Cl^{–}, Na^{+}$ и сложные — $NH_4^{+}, SO_4^{2−}$.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т.е. связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда. Сумма зарядов катионов ($Н^{+}, Na^{+}, NH_4^{+}, Cu^{2+}$) равна сумме зарядов анионов ($Cl^{–}, OH^{–}, SO_4^{2−}$), вследствие чего растворы электролитов ($HCl, (NH_4)_2SO_4, NaOH, CuSO_4$) остаются электронейтральными.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
$HNO_2⇄H^{+}+NO_2^{-}$
5. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы электролита и его концентрации.
6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул $CH_3COOH$, кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов $H^{+}$.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
При растворении в воде кислоты диссоциируют с образованием катионов водорода $Н^{+}$ (точнее, ионов оксония $Н_3О^{–}$), которые определяют общие свойства кислот, такие как кислый вкус, изменение окраски индикатора и др., и отрицательно заряженных ионов, соответствующих кислотным остаткам. При ионной необратимой диссоциации, когда в растворе молекул нет, кислота называется сильной. При обратимой диссоциации, когда в растворе кислоты, наряду с соответствующими ионами, остаются и молекулы, кислота называется слабой. К сильным кислотам относятся азотная, серная, соляная и некоторые другие. Слабые кислоты — фтороводородная (плавиковая), угольная, сероводородная, фосфорная, органические кислоты и др.
Свойства кислот можно разделить на три группы.
Первая группа объединяет общие свойства кислот, определяемые наличием в их растворах ионов водорода. Это вкус, окраска индикаторов, взаимодействие с металлами, основными оксидами, щелочами, основаниями. Приведем соответствующие сокращенные ионные уравнения:
— с металлами, стоящими в ряду напряжений металлов левее водорода:
$Zn + 2H^{+} = Zn^{2+} + H_2↑;$
— с основными оксидами:
$CuO + 2H^{+} = Cu^{2+} + H_2O;$
— с щелочами:
$H^{+} + OH^{–} = H_2O;$
— с нерастворимыми основаниями:
$Fe(OH)_3 + 2H^{+} + 2H_2O$.
Ко второй группе относятся реакции, определяемые свойствами кислотных остатков. Это специфические для каждой кислоты реакции: образование малорастворимых, иногда окрашенных солей.
Для серной кислоты $H_2SO_4$:
$Ba^{2+} + SO_4^{2–}={BaSO_4↓}↙{белый}$,
для угольной кислоты $H_2CO_3$:
$Ca+CO_3^{2-}={CaCO_3↓}↙{белый}$,
Третью группу составляют реакции, протекание которых обусловлено такими свойствами кислот, как сила кислоты, ее растворимость в воде, прочность молекулы, летучесть. Сильная кислота вытесняет слабую:
${3H_2SO_4}↙{сильная}+Ca_3(PO_4)_2={2H_3PO_4}↙{слабая}+3CaSO_4$
При растворении в воде основания образуют гидроксид-ионы ОН– и положительно заряженные ионы аммония $NH_4^{+}$). Растворимые в воде щелочи являются сильными электролитами, в их растворах молекул гидроксидов нет. Нерастворимые основания — слабые электролиты. Слабым электролитом является и гидроксид аммония $NH_4OH$, который представляет собой соединение молекулы аммиака с молекулой воды $NH_3·H_2O$. Специфические свойства оснований определяются свойствами иона металла.
Соли при растворении в воде диссоциируют с образованием положительно заряженных ионов металла (или аммония $NH_4^{+}$) и отрицательно заряженных кислотных остатков. Эти молекулы определяют поведение солей в растворах.
Например, общие свойства кислот, такие как кислый вкус, изменение окраски индикаторов, обусловлены наличием в их растворах катионов водорода (точнее, ионов оксония $H_3O^{–}$). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др., связаны с присутствием в их растворах гидроксид-ионов $OH^{–}$, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как известно, высокая скорость многих химических реакций в растворах электролитов объясняется тем, что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, т.е. протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
a) $AgNO_3+HCl=AgCl↓+HNO_3$
$Ag^{+}+Cl^{–}=AgCl↓$
Реакция необратима, потому что один из ее продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) $Ba(OH)_2+2HNO_3=Ba(NO_3)_2+2H_2O$
$H^{+}+OH^{–}=H_2O$
Реакция нейтрализации необратима, т.к. образуется малодиссоциирующее вещество — вода.
в) $H_2SO_4+Na_2CO_3=Na_2SO_4+H_2O+CO_2↑$
$2H^{+}+CO_3^{2-}=H_2O+CO_2↑$
Реакция необратима, т.к. образуется углекислый газ $CO_2$ и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают. В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
${CH_3COOH}↙{text»слабый электролит»}+NaOH⇄CH_3COONa+{H_2O}↙{text»слабый электролит»}$
$CH_3COOH+OH^{-}⇄CH_3COO^{-}+H_2O$
Равновесие смещается в сторону образования более слабого электролита — $H_2O$. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.