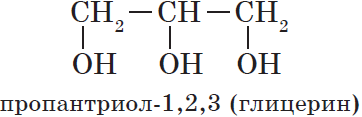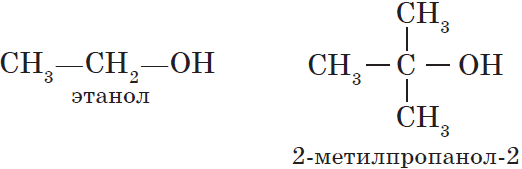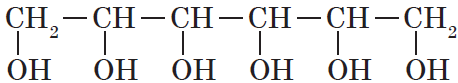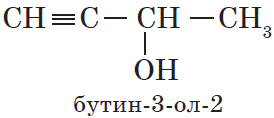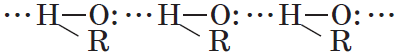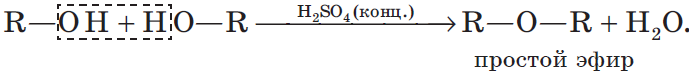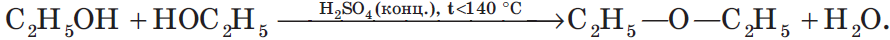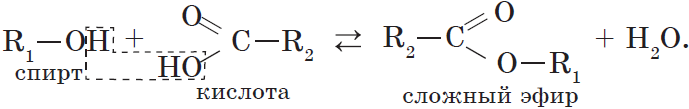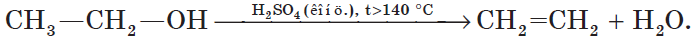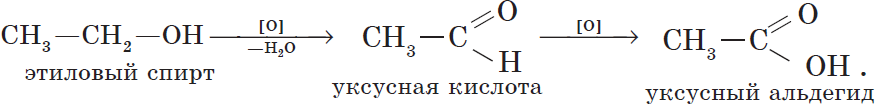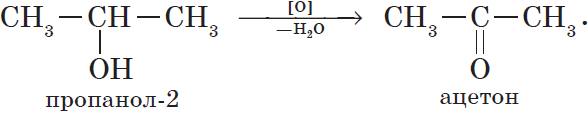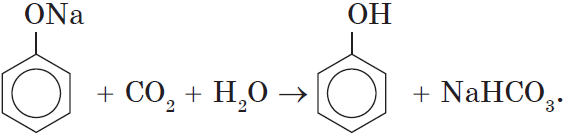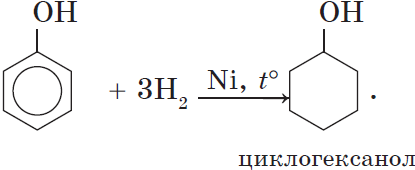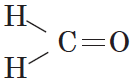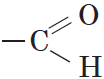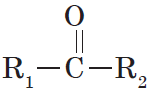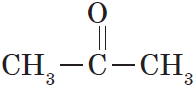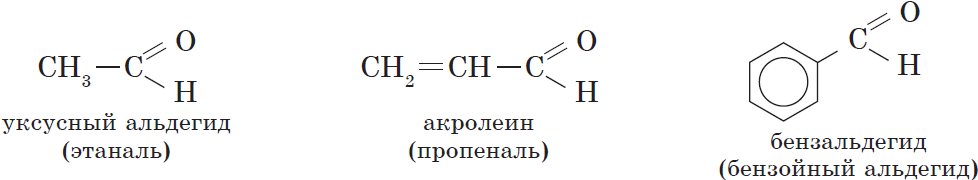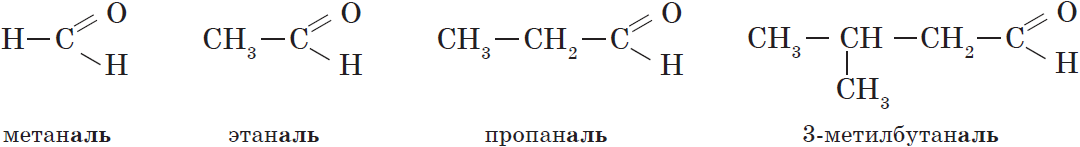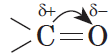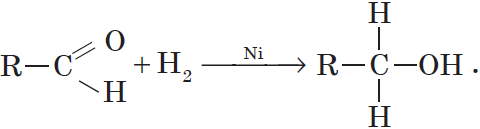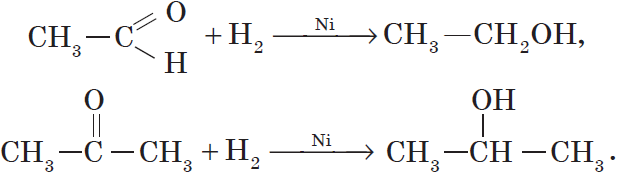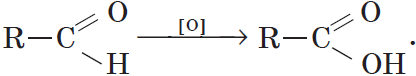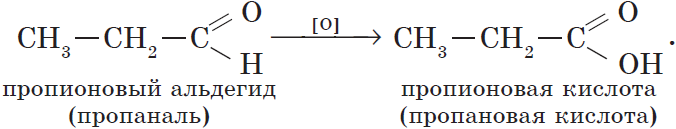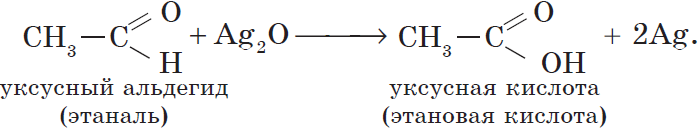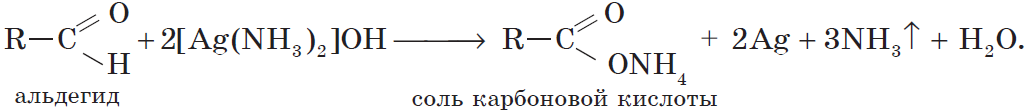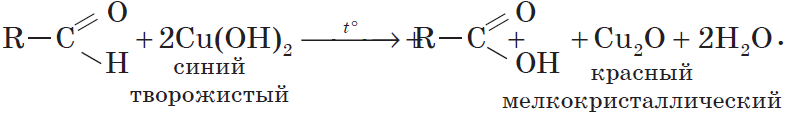Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
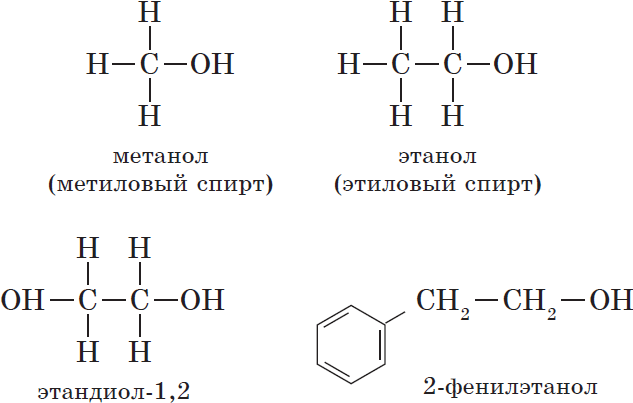
— одноатомные, например:
${CH_3-OH}↙{метанол(метиловый спирт)}$ ${CH_3-CH_2-OH}↙{этанол(этиловый спирт)}$
— двухатомные (гликоли), например:
${OH-CH_2-CH_2-OH}↙{этандиол-1,2(этиленгликоль)}$
${HO-CH_2-CH_2-CH_2-OH}↙{пропандиол-1,3}$
— трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
— непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
${CH_2=CH-CH_2-OH}↙{пропен-2-ол-1 (аллиловый спирт)}$
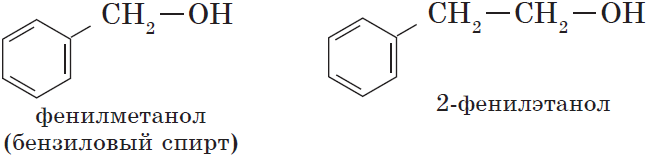
— ароматические, т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
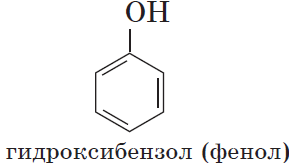
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
${CH_3-CH_2-OH}↙{этанол}$ ${CH_3-O-CH_3}↙{диметиловый эфир}$
Физические и химические свойства спиртов
Физические свойства.
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_{12}Н_{25}ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
$2Na+2H_2O=2NaOH+H_2↑$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2↑$,
$2Na+2ROH=2RONa+H_2↑$.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
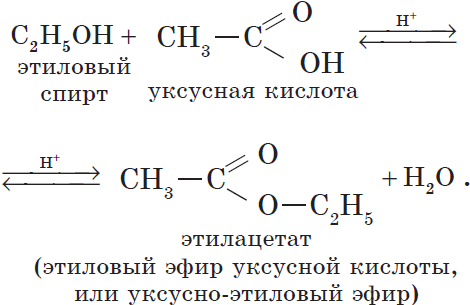
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
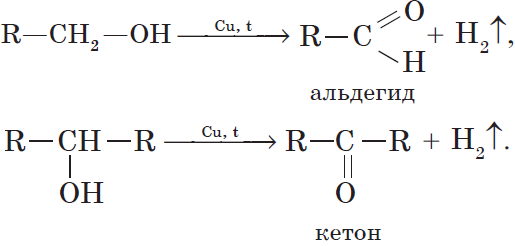
7. Дегидрирование спиртов. При пропускании паров спирта при $200–300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
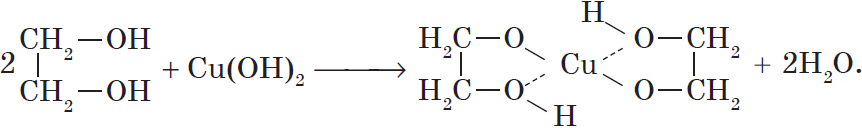
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Фенол
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
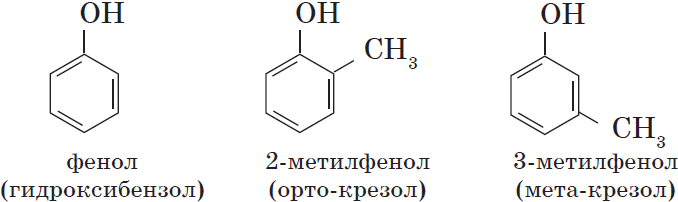
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
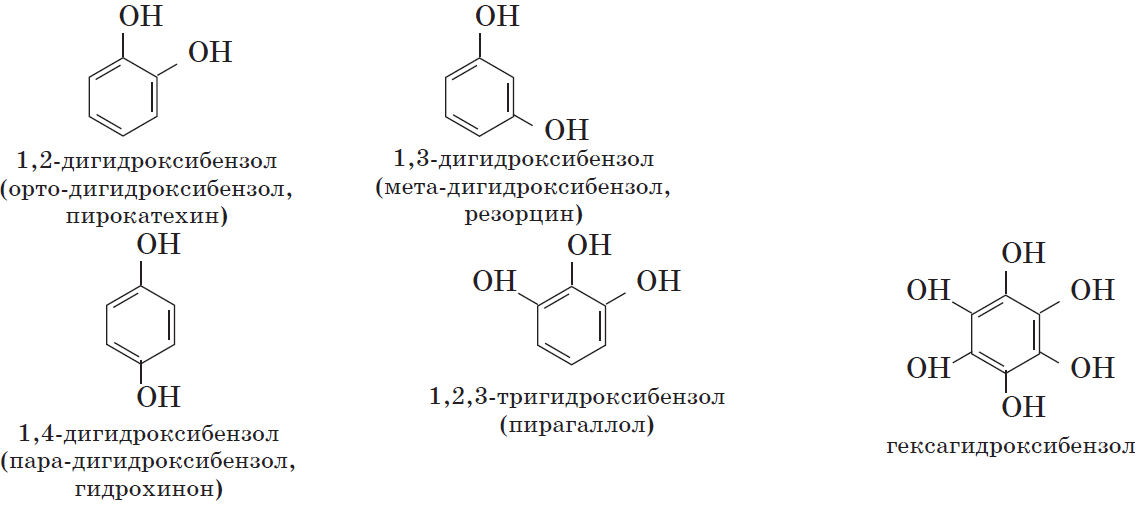
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°{пл.}=43°С, t°{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
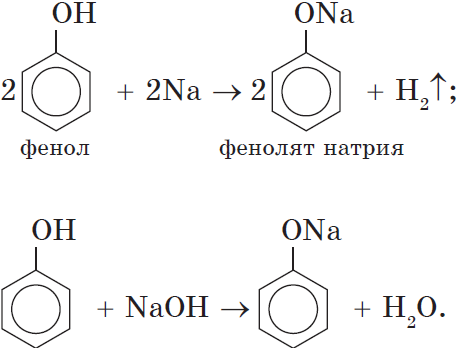
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
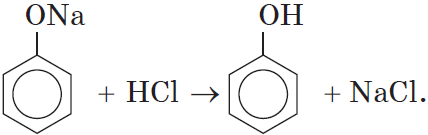
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
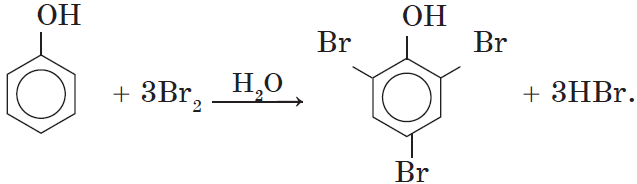
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
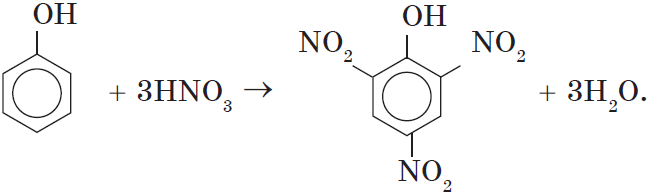
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
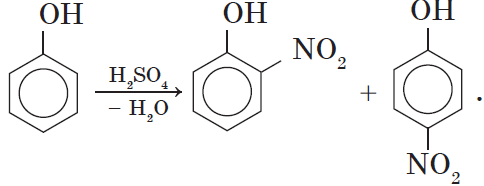
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
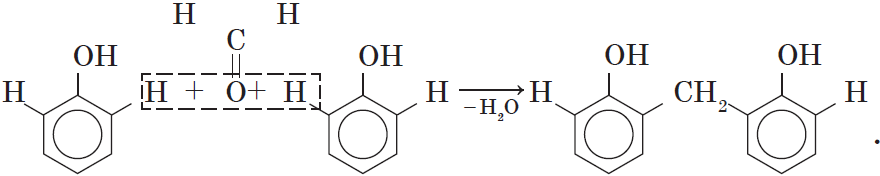
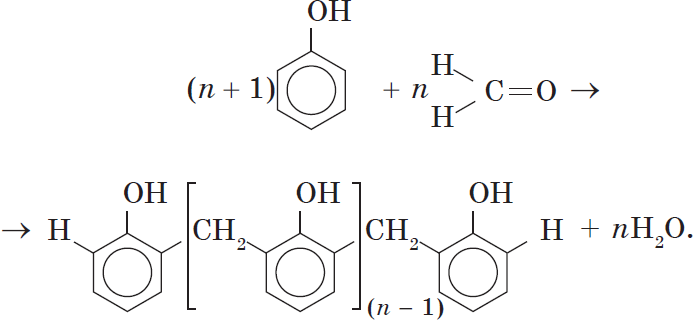
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
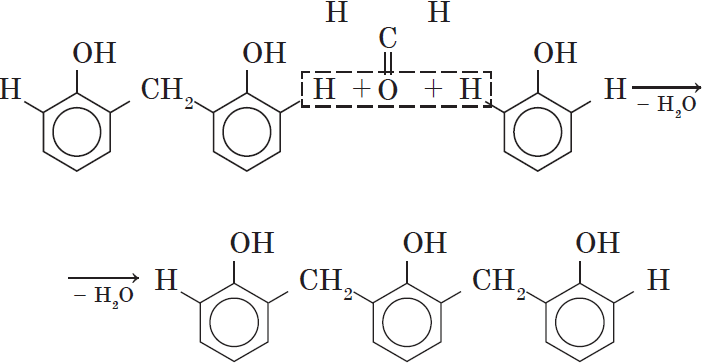
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны
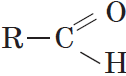
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 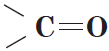
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
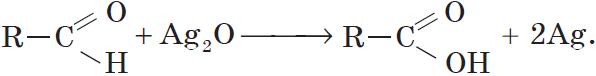
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород
не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным
элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к
брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
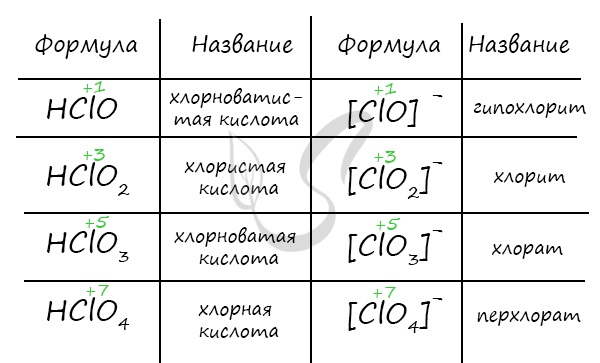
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно
составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
- Хлористая кислота
- Хлорноватая кислота
- Хлорная кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
Cl2 + H2O ⇄ HCl + HClO

KClO + H2O + CO2 → KHCO3 + HClO
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO

Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
H2SO4 + Ba(ClO3)2 → BaSO4↓ + HClO3
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной
кислотой.
KClO4 + H2SO4 → K2SO4 + HClO4

Химические свойства
- Кислотные свойства
- Разложение кислот и солей
- Окислительные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в
реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2

NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и
галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Всего: 14 1–14
Добавить в вариант
Уксусный альдегид в лаборатории получают в результате
1) гидратации ацетилена
2) брожения глюкозы
3) окисления этанола
4) гидролиза хлорэтана
Уксусную кислоту в лаборатории получают из
1) ацетата натрия
2) этиленгликоля
3) этилена
4) ацетона
Ацетон в лаборатории получают прокаливанием
1) ацетата натрия со щёлочью
2) ацетата кальция
3) этанола
4) фенолята кальция
Уксусный альдегид в лаборатории получают взаимодействием этанола с
1) (конц.)
2)
3)
4)
Из предложенного перечня выберите все вещества, из которых в одну стадию можно получить метанол.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите все вещества, из которых в одну стадию можно получить формальдегид.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Из предложенного перечня выберите все вещества, из которых в одну стадию можно получить ацетон.
1) пропаналь
2) диизопропиловый эфир
3) ацетат кальция
4) пропан
5) пропионовая кислота
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите две схемы реакций, в результате которых образуются сложные эфиры.
Запишите номера выбранных ответов.
Источник: ЕГЭ по химии 2020. Досрочная волна. Вариант 1
Диэтиловый эфир в лаборатории получают взаимодействием этанола с
1)
2)
3)
4) (конц)
Из предложенного перечня выберите все вещества, окислением которых можно получить этаналь.
1.
2.
3.
4.
5.
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Источник: СтатГрад: Тренировочная работа 28.11.2018. Вариант ХИ10202.
Задания Д14 № 462
В лаборатории уксусную кислоту получают по схеме
1)
2)
3)
4)
Пропаналь в лаборатории получают взаимодействием
1) пропина с
2) пропанола-1 с
3) 1-хлорпропана с (конц.)
4) пропандиола-1,2
Из предложенного перечня выберите все вещества, из которых в одну стадию можно получить пропанол-1.
1) ацетон
2) пропин
3) 1-бромпропан
4) пропаналь
5) пропилацетат
Запишите в поле ответа номера выбранных веществ.
Из предложенного перечня выберите все вещества, окислением которых можно получить пропионовую кислоту.
1)
2)
3)
4)
5)
Запишите в поле ответа номера выбранных веществ в порядке возрастания.
Всего: 14 1–14
Кислородсодержащие органические соединения. ЕГЭ по химии: теория и практика
- 23.03.2014
Публикуем теоретические и практические задания, которые необходимы при подготовке к ЕГЭ по химии.
Тема: Кислородсодержащие органические соединения
Весь материал соответствует кодификатору ЕГЭ по химии. В конце каждого теоретического блока публикуются практические задания с правильными ответами. Вы можете сразу же проверять качество пройденного материала.
Смотреть в PDF:
Или прямо сейчас: Скачайте в pdf файле.
Добавить комментарий
Комментарии без регистрации. Несодержательные сообщения удаляются.
Задания 17. Характерные химические свойства кислородсодержащих органических соединений.
Задание №1
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) уксусная кислота и сульфид натрия Б) муравьиная кислота и гидроксид натрия В) муравьиная кислота и гидроксид меди (II) (при нагревании) Г) этанол и натрий |
1) пропионат натрия 2) этилат натрия 3) формиат меди (II) 4) формиат натрия 5) ацетат натрия 6) углекислый газ |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 5462
Пояснение:
А) 2CH3COOH + Na2S = 2CH3COONa + H2S
Уксусная кислота, она же этановая, имеет формулу CH3COOH. В результате ее взаимодействия с основными и амфотерными оксидами/гидроксидами, а также при взаимодействии с солями других более слабых кислот образуются соли уксусной кислоты. Соли, а также сложные эфиры уксусной кислоты называют ацетатами или этаноатами. В нашем случае соль CH3COONa может быть названа как ацетат натрия или этаноат натрия.
Б) HCOOH + NaOH = HCOONa + H2O
Муравьиная кислота, она же метановая, имеет формулу HCOOH. В результате ее взаимодействия с основными и амфотерными оксидами/гидроксидами, а также при взаимодействии с солями других более слабых кислот образуются соли муравьиной кислоты. Соли, а также сложные эфиры муравьиной кислоты называют формиатами или метаноатами. В нашем случае соль HCOONa может быть названа как формиат натрия или метаноат натрия.
В) Муравьиная кислота, несмотря на малые размеры своей молекулы, содержит в своем составе сразу две функциональные группы — альдегидную и карбоксильную:
В связи с этим с гидроксидом меди она может реагировать двояко: и по типу альдегида, и по типу простой карбоновой кислоты. По типу кислоты, т.е. с образованием соли, муравьиная кислота реагирует с гидроксидом меди без нагревания. При этом образуется формиат, или метаноат, меди:
2HCOOH + Cu(OH)2 = (HCOO)2Cu + 2H2O (без нагревания)
Для того чтобы муравьиная кислота проявила в реакции с гидроксидом меди свойства альдегида, реакцию следует проводить при нагревании. В таком случае будет протекать реакция, являющаяся качественной для альдегидов. Гидроксид меди частично восстанавливается альдегидной группой, и образуется кирпично-красный осадок оксида меди (I):
HCOOH + 2Cu(OH)2 = Cu2O + CO2 + 3H2O
Г) Спирты способны реагировать с щелочными и щелочноземельными металлами. При этом выделяется водород и образуется соответствующий алкоголят металла. При использовании этилового спирта (этанола) и натрия соответственно образуются этилат натрия и водород:
2C2H5OH + 2Na = 2C2H5ONa + H2
Задание №2
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
|
1) CH3CH2OK 2) CH3COOK 3) CH3COOH 4) CH3CHO 5) (CH3COO)2Cu 6) CH2=CH2 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 4616
Задание №3
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
|
1) бутаналь 2) бутанон 3) бутанол-1 4) бутанол-2 5) бутандиол-1,2 6) бутановая кислота |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
Ответ: 1262
Задание №4
Установите соответствие между схемой реакции и углеродсодержащим продуктом, который является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ РEАКЦИИ |
|
1) CH3COOH 2) CH3CH2OH 3) HCOOH 4) CH3OCH3 5) CH3CH2OCH2CH3 6) (HCOO)2Cu |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 5211
Задание №5
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
|
|
1) K 2) KOH (раств.) 3) HBr 4) CuO 5) Br2 6) H2SO4(конц.) |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 4361
[adsp-pro-3]
Задание №6
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
|
|
1) метилацетат 2) этилформиат 3) метилформиат 4) этиловый эфир уксусной кислоты 5) дипропиловый эфир 6) метилэтиловый эфир |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 1452
Задание №7
Установите соответствие между реагирующими веществами и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
|
А) CH3-CH2-CH2OH (KMnO4, H+) → Б) CH3-CH(OH)-CH3 (KMnO4, H+) → В) CH3-CH2-CHO (KMnO4, H+) → Г) CH3-CH(OH)-CH3 (CuO, t0) → |
1) пропилен 2) пропанол-1 3) пропанол-2 4) пропандиол-1,2 5) пропанон 6) пропановая кислота |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6565
Задание №8
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 5621
Задание №9
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6225
Задание №10
Установите соответствие между веществом и продуктом, который преимущественно образуется при взаимодействии этого вещества с гидроксидом меди (II): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) CH2(OH)-CH2(OH) Б) HCOOH (без нагревания) В) CH3COOH Г) HCOOH (с нагреванием) |
1) формиат меди (II) 2) углекислый газ 3) ацетат меди (II) 4) гликолят меди (II) 5) этанол 6) этаналь |
Запишите в таблицу номера выбранных веществ в порядке возрастания номеров.
Решение
Ответ: 4132
[adsp-pro-3]
Задание №11
Установите соответствие между схемой реакции и органическим веществом, которое является ее продуктом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 1424
Задание №12
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромом в присутствии катализатора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ БРОМИРОВАНИЯ |
|
А) метилбензол Б) бензойная кислота В) уксусная кислота Г) пропионовая кислота |
1) 3-бромбензойная кислота 2) 4-бромбензойная кислота 3) бромэтановая кислота 4) 2-бромпропионовая кислота 5) м-бромтолуол 6) п-бромтолуол |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6134
Задание №13
Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных реакций под соответствующими буквами.
Решение
Ответ: 5314
Задание №14
Установите соответствие между схемой реакции и реагентом, с помощью которого можно получить соответствующую соль: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6341
Задание №15
Установите соответствие между реагентом и углеродсодержащим веществом, образующимся при взаимодействии реагента с водным раствором гидроксида калия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 2336
[adsp-pro-3]
Задание №16
Установите соответствие между веществом и кислородсодержащим продуктом, образующимся при взаимодействии этого вещества с водным раствором серной кислоты: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КИСЛОРОДСОДЕРЖАЩИЙ ПРОДУКТ |
|
А) CH3COOCH3 Б) CH3CH2ONa В) CH3COONa Г) CH2=CH-COONa |
1) CH2=CH-COOH 2) CH2(OH)-CH2-COOH 3) CH3COOH 4) CH3CH2OCH2CH3 5) CH3CH2OH 6) CH3-CH(OH)-COOH |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 3532
Задание №17
Установите соответствие между веществом и кислородсодержащим продуктом, образующимся при взаимодействии этого вещества с водным раствором KOH: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | КИСЛОРОДСОДЕРЖАЩИЙ ПРОДУКТ |
|
А) CH3COOH Б) CH2ClCH2OH В) CH3COOCH2CH3 Г) C6H5-OH |
1) CH2(OH)CH2OH 2) CH2(OH)CH2OK 3) CH3COOH 4) CH3COOK 5) CH3CH2OK 6) C6H5-OK |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 4146
Задание №18
Установите соответствие между веществом и неорганическим соединением, с которым это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | НЕОРГАНИЧЕСКОЕ СОЕДИНЕНИЕ |
|
А) C6H5-OH Б) CH3CH3CHO В) CH3COOCH2CH3 Г) CH3OH |
1) [Ag(NH3)2]OH 2) H2O (H+) 3) Ag 4) CuO 5) Na2SO4 6) FeCl3 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6124
Задание №19
Установите соответствие между схемой реакции и веществом X, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 4354
Задание №20
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
|
А) фенол и бромная вода Б) муравьиная кислота и гидрокарбонат калия В) этилформиат и KOH (водн.) Г) этиленгликоль и гидроксид меди (II) |
1) этилен 2) 2,4,6-трибромфенол 3) гликолят меди (II) 4) формиат калия 5) этилат калия 6) бромбензол |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 2443
[adsp-pro-3]
Задание №21
Установите соответствие между химическим процессом и органическим веществом, которое является продуктом в этом процессе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКИЙ ПРОЦЕСС | ПРОДУКТ |
|
А) межмолекулярная дегидратация пропанола-2 Б) щелочной гидролиз 2,2-дихлорпропана В) каталитическое окисление метанола Г) внутримолекулярная дегидратация пропанола-1 |
1) пропилен 2) пропаналь 3) пропанон 4) метаналь 5) диметиловый эфир 6) диизопропиловый эфир |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6341
Задание №22
Установите соответствие между схемой реакции и веществом Х, принимающим участие в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО X |
|
А) CH3CH2CHO Б) CH3CH2OH В) CH3CH2OK Г) CH3OK |
1) H2 2) H2O 3) CH3I 4) CuO 5) CuSO4 6) Cu(OH)2 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6423
Задание №23
Установите соответствие между схемой реакции и веществом Х, принимающим участие в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО X |
|
А) C6H5CH2OH Б) C6H5CHO В) C6H5COONa Г) C6H5CHO |
1) H2 2) K 3) NaOH 4) H2SO4 5) CuO 6) Cu(OH)2 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 5631
Задание №24
Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО X |
|
А) фенол Б) фенол В) уксусная кислота Г) пропанол-2 |
1) HBr 2) NaOH 3) NaHCO3 4) Br2 (водн.) 5) Cu(OH)2 6) CuBr2 |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 4251
Задание №25
Установите соответствие между схемой реакции гидролиза сложного эфира и преимущественно образующимися продуктами реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ РЕАКЦИИ |
|
А) HCOOC2H5 + H2O Б) HCOOC2H5 + H2O В) CH3COOC2H5 + H2O Г) CH3COOC2H5 + H2O |
1) муравьиная кислота и этанол 2) муравьиная кислота и хлорэтан 3) ацетат натрия и этанол 4) уксусная кислота и этанол 5) уксусная кислота и хлорэтан 6) формиат натрия и этанол |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 6134
[adsp-pro-3]
Задание №26
Установите соответствие между схемой реакции и органическим веществом, которое является продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ РЕАКЦИИ |
|
А) CH3CH2COONa Б) CH3CHCl2 В) C6H5COOH Г) C6H5OH |
1) этан 2) пропан 3) этанол 4) этаналь 5) фенолят натрия 6) бензоат натрия |
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
Решение
Ответ: 1465
[adsp-pro-10]