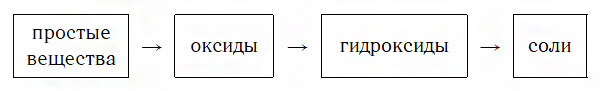
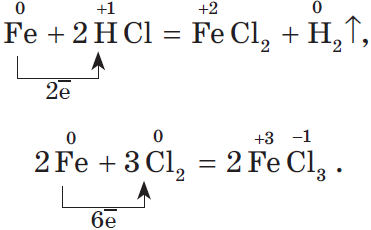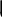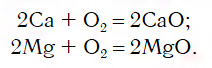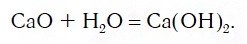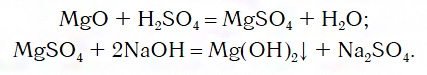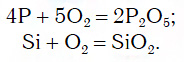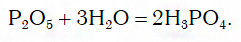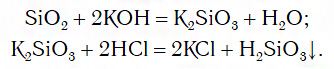Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
${Fe}↙{text»металл»}→{FeCl_2}↙{text»соль — хлорид железа(II)»}$ $→{Fe(OH)_2}↙{text»основание — гидроксид железа(II)»}$ $→{FeO}↙{text»основный оксид — оксид железа(II)»}$ $→{Fe}↙{text»металл»}$ $→{FeCl_3}↙{text»соль — хлорид железа(III)»}$ $→{Fe(OH)_3}↙{text»гидроксид железа (III) — амфотерное соединение с преобладанием основных свойств»}$ $→{Fe_2O_3}↙{text»оксид железа(III), аналогичен по свойствам соответствующему гидроксиду»}$ $→{Fe}↙{text»металл»}$
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
${S}↙{text»неметалл»} → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {H_SO_3}↙{text»сернистая кислота»}$ $ → {Na_SO_3}↙{text»соль — сульфит натрия»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»}$ $ → {SO_3}↙{text»кислотный оксид — оксид серы (VI)»} $ $ → {H_SO_4}↙{text»серная кислота»}$ $ → {SO_2}↙{text»кислотный оксид — оксид серы (IV)»} $ $→ {S}↙{text»неметалл»}$
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
${SO_2}↖{+4}+2H_2{S}↖{-2}=2H_2O+S↖{0}↓.$
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
$K{Cl}↖{+5}O_3+6H{Cl}↖{-1}=K{Cl}↖{-1}+3{Cl_2}↖{0}↑+H_2O.$
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
5.1. Общие представления
Задания по этой
теме представлены в контрольной работе
ЕГЭ на базовом и высоком уровне сложности.
Успешное выполнение этих заданий
возможно лишь в том случае, если учащимися
будут усвоены свойства и способы
получения неорганических веществ
различных классов, а также возможности
взаимного перехода соединений.
Генетическая связь
между классами неорганических веществ
может быть представлена следующей
схемой:
|
Металл
|
|
Н еметалл |
||
|
О
|
|
С оль |
К ислотный |
|
|
|
|
|||
|
Основание |
Кислота |
Однако следует
учесть, что предложенная схема не
отражает всех особенностей взаимосвязи
между различными классами неорганических
веществ, так как не все вещества можно
получить прямым методом. Так, кислород
непосредственно не взаимодействует с
серебром, золотом, платиной, галогенами,
о чем часто забывают школьники. Оксиды
этих элементов получают косвенным
путем. Например, оксид хлора(VII)
Cl2O7
получают действием Р2О5
на хлорную кислоту:
2НСlO4
+ P2O5
= Cl2O7
+ 2HPO3
Взаимодействие
азота с кислородом приводит к образованию
несолеобразующего оксида азота(II)
NO,
остальные оксиды азота получают другими
методами. Так, оксид азота(V)
N2O5
получают способом, аналогичным способу
получения Cl2O7,
т.е. путем действия P2O5
на HNO3:
HNO3
+ P2O5
= N2O5
+ HPO3.
Следует обратить
внимание также на то, что не все основные
и кислотные оксиды взаимодействуют с
водой с образованием соответствующих
гидроксидов (оснований или кислот). Так,
чтобы получить гидроксиды неактивных
и малоактивных металлов, оксид сначала
следует перевести в соль путем его
взаимодействия с кислотой, а затем на
полученную соль подействовать раствором
щелочи. Например, для получения гидроксида
железа(II)
необходимо осуществить реакции:
FeO + 2HCl
= FeCl2
+ H2O
FeCl2
+ 2KOH = Fe(OH)2↓
+ 2KCl
Аналогично, слабую
нерастворимую кремневую кислоту нельзя
получить при взаимодействии SiO2
с водой. Сначала оксид кремния(IV)
обрабатывают щелочью, получая растворимую
соль — силикат, на который затем действуют
кислотой:
SiO2
+ 2NaOH = Na2SiO3
+ H2O
Na2SiO3
+ H2SO4
= H2SiO3↓
+ Na2SO4
5.2. Примеры заданий по теме «Генетическая связь между различными классами неорганических веществ» и комментарии к их решению
Приведем сначала
примеры заданий базового
уровня сложности,
которые проверяют знание генетической
взаимосвязи неорганических веществ
различных классов.
1.
В схеме
превращений
СaO
Сa(OH)2
СaSO3
веществами Х1
и Х2
соответственно являются
|
1) |
H2O |
|
2) |
H2O |
|
3) |
H2 |
|
4) |
КOH |
Гидроксид кальция
можно получить, добавив к оксиду кальция
воду («гашение извести»):
СаО + Н2О
= Сa(OH)2
При взаимодействии
гидроксида кальция с SO3
образуется
сульфат кальция СаSO4,
но не сульфит кальция СаSO3.
Это — типичная ошибка учащихся! Сульфит
кальция можно получить из гидроксида
кальция при его взаимодействии с SO2
или по обменной реакции с растворимым
сульфитом — K2SO3:
Сa(OH)2
+ K2SO3
= СaSO3↓
+ 2КОН
Ответ:
2.
2. В
схеме превращений
CuО
X1
X2
веществом Х2
является
|
1) |
CuCl |
|
2) |
CuCl2 |
|
3) |
CuOH |
|
4) |
Cu(OH)2 |
При взаимодействии
оксида меди(II)
CuO
с соляной кислотой НCl
образуется хлорид меди(II)
CuCl2:
CuО
+ 2HCl
= CuCl2
+ H2O.
Добавление
гидроксида натрия к полученной соли
приводит к образованию гидроксида
меди(II)
Cu(OH)2:
CuCl2
+ 2NaOH
= Cu(OH)2
+ 2NaOH
Ответ:
4.
3. В
схеме превращений
Fe
X1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
FeCl3 |
|
2) |
FeСl2 |
|
3) |
FeСl2 |
|
4) |
FeCl3 |
Выполняя это
задание, следует помнить, что железо
окисляется до степени окисления +2 под
действием слабых окислителей (Н+,
S.
и др.), а до степени окисления +3 – под
действием сильных окислителей (галогены
— Cl2,
Br2,
азотная кислота, концентрированная
серная кислота при нагревании). НCl
– слабый окислитель за счет ионов Н+,
поэтому в результате первого превращения
образуется хлорид железа(II)
FeCl2,
который при взаимодействии со щелочью
дает гидроксид железа(II)
Fe(OH)2.
Ответ:
2.
4. В
схеме
превращений
Fe
FeCl3
X2
веществами Х1
и Х2
соответственно являются
|
1) |
HCl |
|
2) |
HCl и |
|
3) |
Cl2 |
|
4) |
Cl2 |
Рассуждая, как и
в предыдущем задании, делаем вывод, что
железо окисляется до степени окисления
+3 под действием Cl2,
но не НCl.
Взаимодействие полученного в результате
первой реакции хлорида железа(III)
со щелочью приводит к образованию
хлорида железа(III)
Fe(OH)3.
Ответ:
4.
5. В
схеме превращений
C
X1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
CO |
|
2) |
CO |
|
3) |
CO2 |
|
4) |
CO2 |
В избытке кислорода
углерод сгорает с образованием углекислого
газа СО2.
При взаимодействии СО2
с избытком щелочи образуется средняя
соль Na2CO3,
а с недостатком щелочи – кислая соль
NaHCO3.
Ответ:
4.
6. В
схеме превращений
NO
Х1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
NO2 |
|
2) |
N2O3 |
|
3) |
NO2 |
|
4) |
N2O5 |
Оксид азота(II)
легко окисляется кислородом до оксида
азота(IV),
который при растворении в воде в
присутствии кислорода образует азотную
кислоту. В отсутствии кислорода оксид
азота(IV)
при взаимодействии с водой диспропорционирует
с образованием смеси азотистой НNO2
и азотной HNO3
кислот. Ответ:
3.
7. В
схеме превращений
Р
Х1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
P2O3 |
|
2) |
P2O5 |
|
3) |
P2O3 |
|
4) |
P2O5 |
Сгорая в избытке
кислорода, фосфор образует оксид
фосфора(V)
P2O5,
при добавлении к которому избытка щелочи
образуется средняя соль Na3PO4.
Кислые соли – гидрофосфат Na2HPO4
или дигидрофосфат NaH2PO4
– образуются в избытке оксида фосфора(V).
Ответ:
2.
8. В
схеме превращений
Н2S
Х1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
S |
|
2) |
SO2 |
|
3) |
SO3 |
|
4) |
SO2 |
В недостатке
кислорода сероводород сгорает с
образованием серы S,
а в избытке кислорода — с образованием
оксида серы(IV)
SO2.
При пропускании оксида серы (IV)
через избыток щелочи образуется средняя
соль – сульфит калия K2SO3.
В случае избытка оксида серы(IV)
образуется кислая соль KHSO3.
Ответ:
4.
9. В
схеме превращений
NaCl(тв.)
HCl
CuCl2
веществами Х1
и Х2
соответственно являются
|
1) |
H2SO4конц. |
|
2) |
H2SO4разб. |
|
3) |
H2SO4конц. |
|
4) |
H2SO4разб. |
Хлороводород из
твердого хлорида натрия получают,
действуя на него концентрированной,
но не
разбавленной,
серной кислотой при нагревании:
NaCl(тв.).
+ H2SO4(конц.)
= HCl↑ + NaHSO4
Для получения
хлорида меди(II)
можно использовать оксид или гидроксид
меди(II).
В случае использования раствора CuSO4
хлорид меди(II)
получить не удастся вследствие обратимости
реакции. Ответ:
1
10. В
схеме превращений
KI(тв.)
X1
X2
веществами Х1
и Х2
соответственно являются
|
1) |
I2 |
|
2) |
I2 |
|
3) |
HI |
|
4) |
HI |
В отличие от
предыдущего задания, при действии на
йодид натрия концентрированной серной
кислотой при нагревании галогеноводород,
в данном случае — НI,
не образуется, так как вследствие высокой
восстановительной активности йодид-иона
I‾
протекает окислительно-восстановительная
реакция, в результате которой образуется
I2:
8KI(тв.)
+ 5H2SO4(конц.)
= 4I2
+ H2S
+ 4K2SO4
+ 4H2O
В отличие от Cl2
и Br2,
I2
обладает значительно меньшей окислительной
активностью, поэтому он окисляет железо
преимущественно до степени окисления
+2, т.е. до FeI2.
Ответ:
2.
Задания высокого
уровня сложности,
проверяющие знание генетической
взаимосвязи неорганических веществ
различных классов (С2), как показывают
результаты ЕГЭ, являются наиболее
трудными из всех заданий контрольной
работы ЕГЭ. Процент их выполнения самый
низкий. В работах разных лет они имели
различную формулировку. Предлагались
задания, выполнение которых предусматривало
написание уравнений реакций в соответствии
с предложенной схемой (так называемые
«цепочки превращений» веществ). Начиная
с 2006 г. в работе стали использоваться
задания, при выполнении которых требуется
написать уравнения четырех возможных
реакций между предложенными веществами.
В условиях таких заданий отсутствует
жестко заданная схема действий, что
требует от учащихся применения творческого
подхода и демонстрации высокого уровня
познания свойств веществ различных
классов.
В 2012 г. задание С2
будет представлено в двух форматах: в
одних вариантах КИМ — в прежнем формате
(«Даны вещества…»), а в других — в новом,
когда условие задания представляет
собой описание конкретного химического
эксперимента, ход которого экзаменуемый
должен будет отразить посредством
уравнений соответствующих реакций.
При подготовке к
экзамену полезно предлагать учащимся
задания высокого уровня сложности,
проверяющие знание генетической
взаимосвязи неорганических веществ
различных классов, в разных форматах.
В «цепочках
превращений»
формулы (названия) веществ и неизвестные
реагенты (Х1,
Х2
и т.д.) могут обозначаться как исходные
вещества или продукты, а также записываться
над стрелочками, иногда вместе с указанием
условий проведения реакции (избыток
или недостаток реагента, температура,
катализатор и т.п.). Для правильного
написания последовательности уравнений
реакций необходимо внимательно
проанализировать состав, строение и
свойства всех реагентов, определить
характер изменений, происшедших с
исходным веществом.
Следует также
обратить внимание учащихся на то, что
в некоторых случаях осуществить
превращение одного вещества в другое
можно несколькими способами, однако
записать следует только одно
уравнение
реакции. Дополнительно
записанные уравнения реакций не
оцениваются!
В заданиях, требующих
написать уравнения
четырех возможных реакций между
предложенными веществами,
количество этих веществ может быть
разным – и три, и четыре, и пять. Однако
число уравнений реакций должно быть
только четыре. Кроме того, в заданиях
последних лет указано, что пары
реагентов повторять нельзя.
Например, ортофосфорная кислота может
реагировать с гидроксидом натрия с
образованием трех видов солей –
нормальной (ортофосфата Na3PO4)
и двух кислых (гидрофосфата Na2HPO4
и дигидрофосфата NaH2PO4),
чему соответствует три уравнения
реакций:
3NaOH +
H3PO4
= Na3PO4
+ 3H2O
2NaOH +
H3PO4
= Na2HPO4
+ 2H2O
NaOH
+ H3PO4
= NaH2PO4
+ H2O
В бланк ответа
следует записать только одно из этих
уравнений! Как
и в случае «цепочек превращений»,
дополнительно
записанные уравнения реакций не
оцениваются!
Для успешного
выполнения задания необходимо
проанализировать и учесть все
свойства
представленных в задании веществ, т.е.
кислотно-основные, окислительно-восстановительные
и специфические, присущие именно этому
конкретному веществу.
Задание, требующее
записать уравнения реакций,
соответствующих описанию
«мысленного»
химического
эксперимента,
по своей сути является той же «цепочкой
превращений», но представленной словесно,
а не в виде схемы. Чтобы справиться с
этим заданием, часто необходимо кроме
химических свойств веществ знать также
их физические свойства (агрегатное
состояние, цвет, запах и т.д.).
Далее приведем
примеры заданий
высокого
уровня сложности,
проверяющие знание генетической
взаимосвязи неорганических веществ
различных классов (С2), в разных форматах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Всего: 669 … 81–100 | 101–120 | 121–140 | 141–160 | 161–180 | 181–200 | 201–220 | 221–240 …
Добавить в вариант
Сероводород пропустили через раствор нитрата меди (II). Выпавший осадок отфильтровали и подвергли обжигу на воздухе. Твёрдый остаток от сгорания нагрели и выдержали в токе аммиака. Полученное твёрдое вещество растворили в растворе хлорида железа (III). Напишите уравнения четырёх описанных реакций.
Оксид меди (II) нагрели в атмосфере водорода. Образовавшееся твёрдое вещество растворили в концентрированной серной кислоте. Полученная соль прореагировала с йодидом калия, а выделившийся газ смешали с хлором и пропустили через раствор гидроксида калия.
Источник: ЕГЭ по химии 2016. Основная волна (Часть С)
Смешали растворы нитрата кальция и фосфата натрия. Выпавший осадок прокалили в присутствии оксида кремния и угля. Полученное простое вещество обработали концентрированным раствором азотной кислоты. Выделившийся газ прореагировал с холодным раствором гидроксида бария.
Источник: ЕГЭ по химии 20.06.2016. Основная волна. Вариант 78 (Часть С)
Гранулы кальция нагрели с необходимым количеством фосфора. Продукт реакции поместили в воду, в результате чего выделился бесцветный ядовитый газ. В образовавшийся раствор добавили раствор сульфита натрия, в результате чего выпал белый осадок, а газ пропустили через щелочной раствор перманганата натрия.
Напишите уравнения четырёх описанных реакций.
Источник: Задания 31 (С2). Сергей Широкопояс: Химия — подготовка к ЕГЭ 2016
В заданной схеме превращений
веществами X и Y соответственно являются:
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Нитрат калия нагрели с порошкообразным свинцом до прекращения реакции. Смесь продуктов обработали водой, а затем полученный раствор профильтровали. Фильтрат подкислили серной кислотой и обработали иодидом калия. Выделившееся простое вещество нагрели с концентрированной азотной кислотой. В атмосфере образовавшегося при этом бурого газа сожгли красный фосфор.
Запишите уравнения описанных реакций.
В заданной схеме превращений
(амальг.)
веществами X и Y соответственно являются:
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между веществами и реагентами, с которыми они могут взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛЫ РЕАГЕНТОВ
1) (разб) ,
2)
3)
4)
5)
6)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. Образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа.
В заданной схеме превращений
веществами X и Y соответственно являются:
1)
2)
3)
4)
5)
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Установите соответствие между исходными веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Порошок алюминия нагрели с порошком серы, полученное вещество обработали водой. Выделившийся при этом осадок обработали избытком концентрированного раствора гидроксида калия до его полного растворения. К полученному раствору добавили раствор хлорида алюминия и вновь наблюдали образование белого осадка.
Запишите уравнения описанных реакций.
Смешали растворы нитрата бария и карбоната аммония. Выпавший осадок прокалили, а к твёрдому остатку добавили разбавленную серную кислоту. Образовавшееся твёрдое вещество отфильтровали, а затем поместили в горизонтальную стеклянную трубку и нагревали в токе водорода в течение длительного времени. Напишите уравнения четырёх описанных реакций.
Железо нагрели в токе хлора. Полученное вещество растворили в воде и прилили раствор карбоната натрия. Выпавший осадок отфильтровали, добавили к нему щелочной раствор гипохлорита натрия и смесь нагревали до полного растворения осадка. Из полученного раствора под действием хлорида бария выпадает фиолетовый осадок. Напишите уравнения четырёх описанных реакций.
Газ, полученный действием концентрированной серной кислоты на твёрдый хлорид натрия, пропускали в течение длительного времени над нагретым железом. Полученное твёрдое вещество растворили в воде, добавили щёлочь, выпавший осадок прокалили в инертной атмосфере. Напишите уравнения четырёх описанных реакций.
Железо нагрели в токе газообразного хлора. Полученное вещество растворили в воде и прилили избыток раствора карбоната натрия. Выпавший осадок отфильтровали и прокалили. Полученное твёрдое вещество выдерживали при сильном нагревании в токе водорода, смешанного с парами воды. Получили чёрный порошок, представляющий собой бинарное соединение. Напишите уравнения четырёх описанных реакций.
Хром растворили в соляной кислоте в присутствии кислорода воздуха. К полученному раствору добавили избыток карбоната натрия, выпавший осадок отфильтровали и прокалили. Полученное твёрдое вещество смешали с углём и выдержали в токе хлора при нагревании. Получили порошок, представляющий собой соль металла. Напишите уравнения четырёх описанных реакций.
К раствору сульфата железа (II) прилили раствор щёлочи. Выпавший осадок отделили и добавили к нему раствор перекиси водорода. К образовавшемуся осадку бурого цвета прилили раствор иодоводородной кислоты. Полученное простое вещество растворили в тёплом растворе гидроксида калия.
Источник: ЕГЭ — 2017
При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
Источник: Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ—2020 по химии, Демонстрационная версия ЕГЭ−2019 по химии
При нагревании смеси нитрита натрия и хлорида аммония выделился газ, который пропустили над нагретым магнием. При добавлении воды к полученному твёрдому веществу выделился другой газ, который пропустили над нагретым оксидом меди(II), в результате чего последний превратился в вещество красного цвета. Напишите уравнения четырёх
описанных реакций.
Всего: 669 … 81–100 | 101–120 | 121–140 | 141–160 | 161–180 | 181–200 | 201–220 | 221–240 …
Инфоурок
›
Химия
›Тесты›Задания по химии для подготовки к ЕГЭ на тему «Генетическая связь неорганических веществ»
Задания по химии для подготовки к ЕГЭ на тему «Генетическая связь неорганических веществ»
Скачать материал
Скачать материал




- Сейчас обучается 40 человек из 30 регионов


- Сейчас обучается 338 человек из 68 регионов


Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 153 460 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
-
«Химия. Профильный уровень», Габриелян О.С., Лысова Г.Г.
Тема
§ 32. Генетическая связь между классами неорганических и органических веществ
Больше материалов по этой теме
Другие материалы

- 17.09.2021
- 339
- 10

- 17.09.2021
- 204
- 4



- 17.09.2021
- 291
- 7



Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс профессиональной переподготовки «Клиническая психология: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Деятельность по хранению музейных предметов и музейных коллекций в музеях всех видов»
-
Курс профессиональной переподготовки «Метрология, стандартизация и сертификация»
-
Курс профессиональной переподготовки «Эксплуатация и обслуживание общего имущества многоквартирного дома»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Осуществление и координация продаж»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Скачать материал
-
17.09.2021
490
-
DOCX
47.5 кбайт -
30
скачиваний -
Рейтинг:
1 из 5 -
Оцените материал:
-
-
Настоящий материал опубликован пользователем Васильева Елена Александровна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 6 лет и 5 месяцев
- Подписчики: 0
- Всего просмотров: 3360
-
Всего материалов:
7
- Основные классы неорганических соединений
Генетическая связь основных классов неорганических соединений
- а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения: Na2SnO2
Sn→ SnCl2→ Sn(OH2 ≤
Sn(NO3)2
б). Какие из приведенных веществ будут взаимодействовать между собой:
Ca(OH)2 и NaOH; Pb(OH)2 и KOH; H2SO4 и H2SO3; HCl и Na2S; HNO3 и MgO?
Написать уравнения соответствующих реакций.
1.2. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3.
б). Какие из приведенных оксидов будут реагировать с HCl: N2O5; SO3; Al2O3;
Cl2O7; ZnO; K2O? Написать уравнения соответствующих реакций.
1.3. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
P → P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2.
б). Закончить уравнения реакций, доказывающих амфотерность оксида
свинца (II): основные свойства PbO + HNO3 → …;
кислотные свойства PbO + KOH →спавление … .
1.4. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
N2 → NH3 → (NH4)2SO4 → NH4Cl → NH3 → NH4NO3.
б). Какие из приведенных оксидов реагируют с NaOH: MgO; Cl2O; Na2O;
CrO3; CaO; CO2? Составить уравнения соответствующих реакций.
1.5. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
Si → SiO2 → K2SiO3 → H2SiO3 → SiO2.
б). Какие из указанных ниже веществ могут взаимодействовать с раствором
KOH: HI; CuCl2; SO2; Ba(OH)2; SnO? Написать уравнения соответствующих
реакций.
1.6. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
CaSO3 ← SO2 ← S → FeS → H2S → KHS.
б). Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: Na2S; Fe2(SO4)3; K 3PO4.
1.7. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Ca → Ca(OH)2 → CaCO3 → CaCl2 → Ca3(PO4)2.
Na2SnO2
Sn→ SnCl2 →Sn(OH)2 ≤
Sn(NO3)2
б). Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3; CaHРO4; CuOHCl.
1.8. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Cu → CuO → Cu(NO3)2 → Cu(OH)2 → CuCl2.
б). Между какими из приведенных пар веществ возможна реакция: CO2 и SO2;
LiOH и CO2; P2O5 и CaO; NaOH и KOH; Li2O и ZnO; Li2O и Na2O? Составить
уравнения соответствующих реакций.
1.9. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Cd → CdO → Cd(NO3)2 → Cd(OH)2 → CdSO4.
б). С какими из указанных ниже веществ может взаимодействовать серная
кислота: HCl; BaCl2; MgO; CO2; NaOH; ZnO? Составить уравнения
соответствующих реакций.
1.10. а). Составить уравнения реакций, при помощи которых можно
осуществить следующие превращения:
Zn → ZnCl2 → Zn(OH)2 → ZnO → K2ZnO2.
б). Написать уравнения реакций образования солей: Na2SO3; Fe2(SO4)3;
Ba(NO3)2 в результате взаимодействия основания и кислотного оксида.
1.11. а). Составить уравнения реакций, при помощи которых можно
осуществить следующие превращения:
S → SO2 → SO3 → H2SO4 → KHSO4 → K2SO4.
б). Составить уравнения реакций образования солей: CaCO3; Al2(SO4)3;
Na3PO4 в результате взаимодействия основного и кислотного оксидов.
1.12. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al → Al2(SO4)3 → Al(OH)3 → Al2O3 → KAlO2.
б). Закончить уравнения реакций, доказывающих амфотерность оксида
олова (II): основные свойства SnO + HCl → …;
кислотные свойства SnO + KOH спавление ….
1.13. а). Составить уравнения реакций, при помощи которых можно
осуществить следующие превращения:
Ba → BaO → Ba(OH)2 → Ba(NO3)2 → BaCO3 → BaCl2.
б). Какие из приведенных оксидов взаимодействуют с КОН: Na2O; CO2;
Ga2O3; MgO; CuO; Mn2O7? Написать уравнения соответствующих реакций.
1.14. а). Составить уравнения реакций, при помощи которых можно
осуществить следующие превращения:
Fe(NO3)3 → Fe(OH)3 → Fe2O3 → FeO → FeCl2 → FeS.
б). Какие вещества могут быть получены при взаимодействии кислоты с солью?
Кислоты с основанием? Соли с солью? Привести примеры соответствующих
реакций.
1.15. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Mg → MgSO4 → Mg(OH)2 → MgOHNO3 → Mg(NO3)2.
б). Составить уравнения реакций, при помощи которых, исходя из четырех простых веществ – калия, серы, водорода и кислорода, можно получить гидроксид калия КОН; сульфид калия K2S; сероводородH2S.
1.16. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
ZnSO4 ← ZnO ← ZnS → ZnCl2 → Zn(OH)2 → Na2ZnO2.
б). Написать уравнения не менее четырех реакций, при помощи которых можно получить карбонат кальция CaCO3.
1.17. а). Составить уравнения реакций, при помощи которых можно осуществить следующие превращения:
CuOHCl ← Cu(OH)2 ← CuSO4 ← Cu → CuO → CuCl2.
б). Написать уравнения реакций образования K2CrO4, Mg(NO3)2, BaSO4, Ca(ClO)2 в результате взаимодействия основания и кислотного оксида.
1.18. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → Fe2O3 → FeCl3.
б). Могут ли находиться совместно в растворе: Ba(OH)2 и FeCl3; HCl и H2S; NaOH и НBr; NaOH и KOH; HCl и Na2CO3? Дать обоснованный ответ и привести уравнения соответствующих реакций.
1.19. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Al → Al2O3 → AlCl3 → Al(OH)3 → NaAlO2.
б). Как, используя BaO, FeCl3, H2SO4, H2O, CuO, можно получить: гидроксид бария; гидроксид железа (III); сульфат меди (II)? Составить уравнения соответствующих реакций.
1.20. а). Написать уравнения реакций, при помощи которых можно осуществить следующие превращения:
Pb → PbS → PbO → Pb(NO3)2 → Pb(OH)2 → K2PbO2.
б). Составить уравнения четырех реакций, в результате которых образуется бромид натрия NaBr.
Урок 42. Взаимосвязь между классами неорганических веществ
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
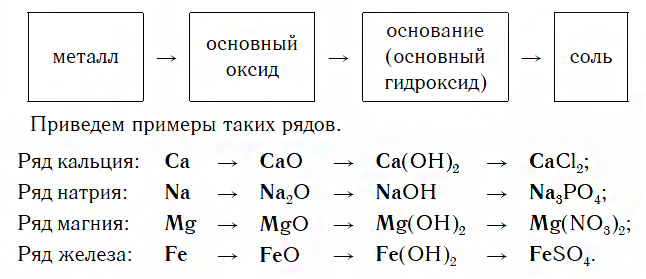
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
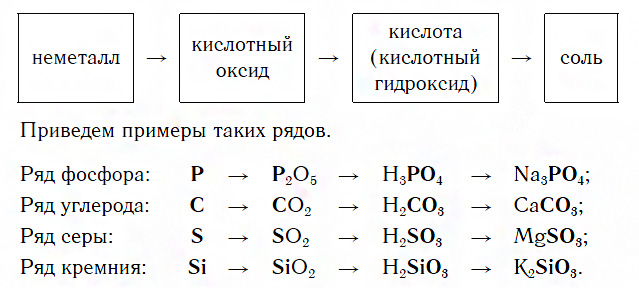
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
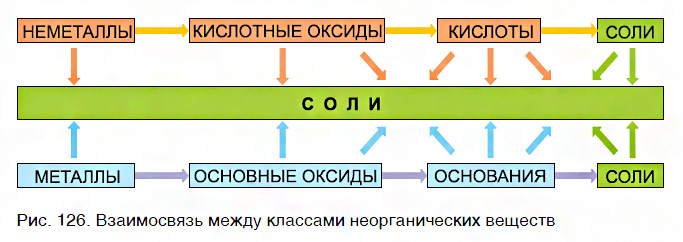
- Вещества одного и того же ряда друг с другом не реагируют.
- Если одно вещество принадлежит к ряду металлов и их соединений, а другое — к ряду неметаллов и их соединений, то эти вещества реагируют друг с другом с образованием солей (рис. 126).
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
- Простые вещества, оксиды, гидроксиды и соли взаимосвязаны между собой.
- 1) металл → основный оксид → основание → соль; 2) неметалл → кислотный оксид → кислота → соль.
- Вещества, принадлежащие к одному ряду, друг с другом не реагируют.
- Вещества, принадлежащие к рядам разных типов, реагируют между собой с образованием солей.
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок №51. Генетическая связь между основными классами неорганических соединений
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
1 . Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K 2 O→KOH→KCl
2 . Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→основный оксид→металл
Например, Cu→CuO→CuCl 2 →Cu(OH) 2 →CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
1 . Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P 2 O 5 →H 3 PO 4 →Na 3 PO 4
2 . Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→кислотный оксид→неметалл
Например, Si→SiO 2 →Na 2 SiO 3 →H 2 SiO 3 →SiO 2 →Si
Взаимосвязь неорганических веществ
Теория к заданию 10 из ЕГЭ по химии
Взаимосвязь различных классов неорганических веществ
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Единство и многообразие химических веществ этого мира наиболее ярко проявляется в генетической связи веществ, которая отражается в так называемых генетических рядах. Выделим наиболее характерные признаки таких рядов:
1. Все вещества этого ряда должны быть образованы одним химическим элементом. Например, ряд, записанный с помощью следующих формул:
$Br_2 → HBr → NaBr → NaNO_3$,
нельзя считать генетическим, т.к. в последнем звене элемент бром отсутствует, хотя реакция для перехода от $NaBr$ к $NaNO_3$ легко осуществима:
$NaBr + AgNO_3 = AgBr↓+ NaNO_3$.
Этот ряд мог бы считаться генетическим рядом элемента брома, если бы его завершили, например, так:
$Br_2 → HBr → NaBr → AgBr$.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам, т.е. отражать разные формы его существования.
3. Вещества, образующие генетический ряд одного элемента, должны быть связаны взаимопревращениями. По этому признаку можно различать полные и неполные генетические ряды.
Например, приведенный выше генетический ряд брома будет неполным, незавершенным. А вот следующий ряд:
$Br_2 → HBr → NaBr → AgBr → Br_2$
уже можно рассматривать как полный: он начинался простым веществом — бромом и им же закончился. Обобщая сказанное выше, можно дать следующее определение генетического ряда.
Генетическим называется ряд веществ — представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
Генетическая связь — понятие более общее, чем генетический ряд, который является пусть и ярким, но частным проявлением этой связи, реализующейся при любых взаимных превращениях веществ. Тогда, очевидно, под это определение подходит и первый приведенный в тексте ряд веществ.
Для характеристики генетической связи неорганических веществ мы рассмотрим три разновидности генетических рядов.
Генетический ряд металла.
Наиболее богат ряд металла, у которого проявляются разные степени окисления. В качестве примера рассмотрим генетический ряд железа со степенями окисления $+2$ и $+3$:
Напомним, что для окисления железа в хлорид железа (II) нужно взять более слабый окислитель, чем для получения хлорида железа (III):
Генетический ряд неметалла.
Аналогично ряду металла более богат связями ряд неметалла с разными степенями окисления, например, генетический ряд серы со степенями окисления $+4$ и $+6$:
Затруднение может вызвать лишь последний переход. Руководствуйтесь правилом: чтобы получить простое вещество из окисленного соединения элемента, нужно взять для этой цели самое восстановленное его соединение, например, летучее водородное соединение неметалла. В нашем случае:
По этой реакции в природе из вулканических газов образуется сера.
Аналогично для хлора:
Генетический ряд металла, которому соответствуют амфотерные оксид и гидроксид, очень богат связями, т.к. они проявляют в зависимости от условий то кислотные, то основные свойства.
Например, рассмотрим генетический ряд цинка:
источники:
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-51-%D0%B3%D0%B5%D0%BD%D0%B5%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D1%81%D0%B2%D1%8F%D0%B7%D1%8C-%D0%BC%D0%B5%D0%B6%D0%B4%D1%83-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%BD%D1%8B%D0%BC%D0%B8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81%D0%B0%D0%BC%D0%B8-%D0%BD%D0%B5%D0%BE%D1%80%D0%B3%D0%B0%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%81%D0%BE%D0%B5%D0%B4%D0%B8%D0%BD%D0%B5%D0%BD%D0%B8%D0%B9
http://examer.ru/ege_po_himii/teoriya/vzaimosvyaz_neorganicheskix_veshhestv
Для данных схем превращений напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
-
СuО → СuSO4 → СuCl2 → Сu(OH)2
NaOH
-
СО2 Х→CaCO3→Ca(NO3)2
-
MgO Mg(NO3)2 Mg(OH)2 MgCl2
H2O
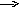
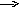
-
P2O5 X K3PO4 Ca3(PO4)2
H2O
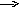
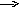
-
Ba X BaBr2 Ba3(PO4)2
t°
-
SiO2 K2SiO3 H2SiO3 X
t°
-
KOH Cu(OH)2 → X Cu(NO3)2
-
Al Al2(SO4)3 Al(OH)3 AlCl3
-
Na2S H2S SO2 BaSO3
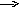
-
СаС2 Ca(OH)2 CaSO4 CaS
Решение
Правильным решением считаются написанные уравнения реакций, соответствующие схеме превращений. В ответе допускаются иные, не противоречащие условию задания уравнения реакций.
1.
1) СuO + H2SO4 = CuSO4 + H2O
2) CuSO4 + BaCl2 = BaSO4 + CuCl2
3) CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
2.
1) CO2 + 2NaOH = Na2CO3 + H2O
2) Na2CO3 + CaCl2 = CaCO3 + 2NaCl
3) CaCO3 + 2HNO3 = Ca(NO3)2 + CO2 + H2O
3.
1) MgO + 2HNO3 = Mg(NO3)2 + H2O
2) Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
3) Mg(OH)2 + 2HCl = MgCl2 + 2H2O
4.
1) P2O5 + 3H2O = 2H3PO4
2) H3PO4 + 3KOH = K3PO4 + 3H2O
3) 2K3PO4 + 3CaCl2 = Ca3(PO4)2 + 6KCl
5.
1) Ва+ Н2O = Ba(OH)2 + H2
2) Вa(OH)2 + 2 HBr =BaBr2+ 2H2O
3) 3BaBr2 + 2Na3PO4 = 6 NaBr + Ba3(PO4)2
6.
SiO2 + 2KOH (сплавление) = K2SiO3 + H2O
K2SiO3 + 2HCl = H2SiO3↓ + 2KCl
H2SiO3= H2O+ SiO2
7.
2 KOH+CuSO4=Cu(OH)2+K2SO4
t°
Cu(OH)2= CuO + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
8.
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
Al2(SO4)3 + 6KOH = 2Al (OH)3 + 3K2 SO4
Al (OH)3 + 3 HCl= AlCl3+ 3H2O
9.
1) Na2S + 2HCl = 2NaCl + H2S
2) 2H2S + 3O2 = 2SO2 + 2H2O
3) SO2 + Ba(OH)2 = BaSO3 + H2O
10.
CaC2 + 2 H2O = Ca (OH)2 + C2H2
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CaSO4 + 3C(кокс) = CaS + 2CO + CO2